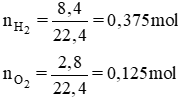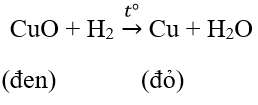Hóa học 8 Bài 31: Tính chất – Ứng dụng của hiđro được THPT Ngô Thì Nhậm biên soạn hy vọng sẽ là là tài liệu hữu ích giúp các em nắm vững kiến thức bài học và đạt kết quả tốt trong các bài thi, bài kiểm tra trên lớp.
Tóm tắt lý thuyết Hóa học 8 Bài 31
– Kí hiệu: H. Nguyên tử khối: 1
– Công thức hóa học của đơn chất: H2. Phân tử khối: 2
Tính chất vật lý
Là chất khí không màu, không mùi, không vị, nhẹ nhất trong các khí, tan rất ít trong nước
Tính chất hóa học
a. Tác dụng với oxi
Nếu đốt cháy hidro trong oxi: hidro cháy mạnh, trên thành lọ xuất hiện những giọt nước nhỏ
PTHH: 2H2 + O2 −to→ 2H2O
Hỗn hợp sẽ gây nổ nếu trộng hidro và oxi theo tỉ lệ thể tích 2:1
b. Tác dụng với đồng oxit CuO
Khi đốt nóng tới khoảng 400°C : bột CuO màu đen chuyển thành lớp kim loại đồng màu đỏ gạch và có những giọt nước tạo thành trên thành cốc
PTHH: H2 + CuO −to→ Cu +H2O
⇒ Hidro đã chiến oxi trong CuO. Vậy hidro có tính khử
⇒ở nhiệt độ thích hợp, hidro có thể kết hợp với nguyên tố oxi trong một số oxit kim loại. do vậy hidro có tính khử. Các phản ứng này đều tỏa nhiệt
Ứng dụng
Do tính chất nhẹ, tính khử và khih cháy tỏa nhiềt nhiệt mà hidro ứng dụng trong đời sống
– làm nguyên liệu cho động cơ tên lửa, nhiên liệu cho động cơ ô tô thay cho xăng
– làm nguyên liệu điều chế axit
– dùng để điều chế kim loại từ oxit của chúng
– bơm vào khinh khí cầu, bóng thám
Giải bài tập SGK Hóa học 8 Bài 31
Bài 1 (trang 109 SGK Hóa 8)
Viết phương trình hóa học của phản ứng hiđro khử các oxit sau:
a) Sắt (III) oxit.
b) Thủy ngân(II) oxit.
c) Chì(II) oxit.
Lời giải:
a) Fe2O3 + 3H2 to→ 2Fe + 3H2O.
b) HgO + H2 to→ Hg + H2O.
c) PbO + H2 to→ Pb + H2O.
Bài 2 (trang 109 SGK Hóa 8)
Hãy kể những ứng dụng của hidro mà em biết.
Lời giải:
Dùng làm nhiên liệu cho động cơ tên lửa, có thể làm nhiên liệu cho động cơ ô tô thay cho xăng, dùng trong đèn xì oxi – hidro để hàn cắt kim loại. Đó là vì khí hiđro cháy, sinh ra một lượng nhiệt lớn hơn nhiều lần so với cùng lượng nhiên liệu khác.
Là nguồn nhiên liệu trong sản xuất amoniac, axit và nhiều hợp chất hữu cơ.
Dùng làm chất khử để điều chế một số kim loại từ oxit của chúng.
Hiđro được dùng để bơm vào khinh khí cầu, bóng thám không vì là khí nhẹ nhất.
Bài 3 (trang 109 SGK Hóa 8)
Chọn cụm từ thích hợp trong khung để điền vào chỗ trống trong các câu sau:
Tính khử; tính oxi hóa; chiếm oxi; nhường oxi; nhẹ nhất
Trong các chất khí, hiđro là khí … Khí hidro có …
Trong phản ứng giữa H2 và CuO, H2 có … vì … của chất khác; CuO có … vì … cho chất khác.
Lời giải:
Trong các chất khí, hiđro là khí nhẹ nhất. Khí hiđro có tính khử.
Trong phản ứng giữa H2 và CuO, H2 có tính khử vì chiếm oxi của chất khác, CuO có tính oxi hoá vì nhường oxi cho chất khác.
Bài 4 (trang 109 SGK Hóa 8)
Khử 48 gam đồng(II) oxit bằng khí hiđro. Hãy:
a) Tính số gam đồng kim loại thu được.
b) Tính thể tích khí hiđro (đktc) cần dùng.
Lời giải:
nCuO = = 0,6 mol.
Phương trình hóa học của phản ứng khử CuO:
CuO + H2 → Cu + H2O.
nCu = 0,6mol.
mCu = 0,6 .64 = 38,4g.
Theo phương trình phản ứng trên:
nH2 = 0,6 mol
VH2 = 0,6 .22,4 = 13,44 lít.
Bài 5 (trang 109 SGK Hóa 8)
Khử 21,7 gam thủy ngân(II) oxit bằng hiđro. Hãy:
a) Tính số gam thủy ngân thu được.
b) Tính số mol và thể tích khí hiđro (đktc) cần dùng.
Lời giải:
nHgO = = 0,1 mol.
Phương trình hóa học của phản ứng khử HgO:
HgO + H2 → Hg + H2O
nHg = 0,1 mol.
mHg = 0,1 .201 = 20,1g.
nH2 = 0,1 mol.
VH2 = 0,1 .22,4 =2,24l.
Bài 6 (trang 109 SGK Hóa 8)
Tính số gam nước thu được khi cho 8,4 lít khí hiđro tác dụng với 2,8 lít oxi (các thể tích đo ở đktc).
Lời giải:
Phương trình hóa học của phản ứng tạo nước:
2H2 + O2 → 2H2O.
So sánh tỉ lệ 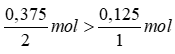
Theo phương trình trên ta có:
nH2O = 2. 0,125 = 0,25 mol.
mH2O = 0,25 .18 = 4,5g.
Trắc nghiệm Hóa học 8 Bài 31 (có đáp án)
Câu 1: Tính chất nào sau đây không có ở Hidro
A. Nặng hơn không khí
B. Nhẹ nhất trong các chất khí
C. Không màu
D. Tan rất ít trong nước
Đáp án: A
Câu 2: Ứng dụng của Hidro
A. Oxi hóa kim loại
B. Làm nguyên liệu sản xuất NH3, HCl, chất hữu cơ
C. Tạo hiệu ứng nhà kinh
D. Tạo mưa axit
Đáp án: B
Câu 3: Khí nhẹ nhất trong các khí sau:
A. H2
B. H2O
C. O2
D. CO2
Đáp án: A
Câu 4: Công thức hóa học của hidro:
A. H2O
B. H
C. H2
D. H3
Đáp án: C
Câu 5: Cho 8g CuO tác dụng với H2 ở nhiệt độ cao. Sau phản ứng thấy có m (g) chất rắn. Tính m, chất rắn đó là chất nào?
A. Cu, m = 0,64g
B. Cu, m = 6,4g
C. CuO dư, m = 4g
D. Không xác định được
Đáp án: B
Câu 5:
PTHH: CuO + H2 −to→ Cu + H2O
→ Chất rắn là Cu
Ta thấy: nCuO = ncu = 0,1 (mol)
→ mCu = n.M = 0,1 .64 = 6,4 (g)
Câu 6: Trong những oxit sau: CuO, MgO, Fe2O3, CaO, Na2O. oxit nào không bị Hidro khử:
A. CuO, MgO
B. Fe2O3, Na2O
C. Fe2O3, CaO
D. CaO, Na2O, MgO
Đáp án: D
Câu 7: Tỉ lệ mol của Hidro và Oxi sẽ gây nổ mạnh là:
A. 2:1
B. 1:3
C. 1:1
D. 1:2
Câu 8: Trong những oxit sau: CuO, MgO, Al2O3, AgO, Na2O, PbO. Có bao nhiêu oxit phản ứng với Hidro ở nhiệt độ cao:
A. 4
B. 5
C. 3
D. 1
Đáp án: C
Câu 9: Sau phản ứng của CuO và H2 thì có hiện tượng gì:
A. Sau phản ứng, chất rắn màu đen chuyển thành xanh lam
B. Sau phản ứng, chất rắn màu đen chuyển thành đỏ
C. Có chất khí bay lên
D. Không có hiện tượng
Đáp án: B
Câu 10: Sản phẩm thu được sau khi nung Chì (II) oxit trong Hidro
A. Pb
B. H2
C. PbO
D. Không phản ứng
Đáp án: A
PbO + H2 −to→ Pb + H2O
******************
Trên đây là nội dung bài học Hóa học 8 Bài 31: Tính chất – Ứng dụng của hiđro do THPT Ngô Thì Nhậm biên soạn bao gồm phần lý thuyết, giải bài tập và các câu hỏi trắc nghiệm có đáp án đầy đủ. Hy vọng các em sẽ nắm vững kiến thức về Tính chất – Ứng dụng của hiđro. Chúc các em học tập thật tốt và luôn đạt điểm cao trong các bài thi bài kiểm tra trên lớp.
Biên soạn bởi: Trường THPT Ngô Thì Nhậm
Chuyên mục: Hoá học 8