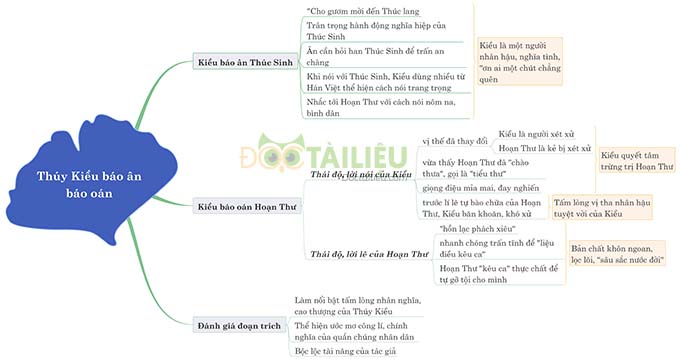
Hóa học 11 Bài 13: Luyện tập: Tính chất của nitơ, photpho và các hợp chất của chúng – Giải bài tập SGK Hóa học 11 Bài 13
Hóa học 11 Bài 13: Luyện tập: Tính chất của nitơ, photpho và các hợp chất của chúng được THPT Ngô Thì Nhậm biên soạn hy vọng sẽ là là tài liệu hữu ích giúp các em nắm vững kiến thức bài học và đạt kết quả tốt trong các bài thi, bài kiểm tra trên lớp.
Tóm tắt lý thuyết Hóa học 11 Bài 13
Kiến thức trọng tâm
Giải bài tập SGK Hóa học 11 Bài 13
Bài 1 (trang 61 SGK Hóa 11)
Hãy cho biết số oxi hóa của N và P trong các phân tử và ion sau đây NH3, NH4+, NO2–, NO3–, NH4HCO3 , P2O3, PBr5, PO43–, KH2PO4, Zn3(PO4)2.
Lời giải:
Bài 2 (trang 61 SGK Hóa 11)
Trong các công thức sau đây, chọn công thức hóa học đúng của magie photphua:
A. Mg3(PO4)2
B. Mg(PO3)2
C. Mg3P2
D. Mg2P2O7
Lời giải:
Đáp án C
Bài 3 (trang 61 SGK Hóa 11)
a) Lập các phương trình hóa học sau đây:
NH3 + Cl2 (dư) → N2 + ..
NH3(dư) + Cl2 → NH4Cl + ….
NH3 + CH3COOH → …
(NH4)3PO4 H3PO4 + …
Zn(NO3)2 …
b) Lập các phương trình hóa học ở dạng phân tử và dạng ion rút gọn của phản ứng giữa các chất sau đây trong dung dịch:
(1) K3PO4 và Ba(NO3)2
(2) Na3PO4 và CaCl2
(3) Ca(H2PO4)2 và Ca(OH)2 với tỉ lệ mol 1:1
(4) (NH4)3PO4 + Ba(OH)2
Lời giải:
a)
b) (1) 2K3PO4 + 3Ba(NO3)2 → Ba3(PO4)2 ↓ + 6KNO3
Ba2+ + 2PO43- → Ba3(PO4)2 ↓
(2) 2Na3PO4 + 3CaCl2 → Ca3(PO4)2 ↓ + 6NaCl
Ca2+ + 2PO43- → Ca3(PO4)2 ↓
(3) Ca(H2PO4)2 + Ca(OH)2 → 2CaHPO4 + 2H2O
H2PO4– + OH– → HPO42- + H2O
(4) 2(NH4)3PO4 + 3Ba(OH)2 → Ba3(PO4)2 ↓ + 6NH3 ↑ + 6H2O
6NH4+ + 2PO43- + 3Ba2+ + 6OH– → Ba3(PO4)2 ↓ + 6NH3 ↑ + 6H2O
Bài 4 (trang 61 SGK Hóa 11)
Từ hiđro, clo, nitơ và các hóa chất cần thiết, hãy viết các phương trình hóa học (có ghi rõ điều kiện phản ứng) điều chế phân đạm amoni clorua.
Lời giải:
Bài 5 (trang 62 SGK Hóa 11)
Viết phương trình hóa học thực hiện các dãy chuyển hóa sau:
Lời giải:
Bài 6 (trang 62 SGK Hóa 11)
Hãy đưa ra những phản ứng đã học có sự tham gia của đơn chất photpho, trong đó số oxi hóa của photpho:
a. Tăng
b. Giảm
Lời giải:
Bài 7 (trang 62 SGK Hóa 11)
Khi cho 3,00 g hỗn hợp Cu và Al tác dụng với dung dịch HNO3 đặc dư, đun nóng, sinh ra 4,48 lít khí duy nhất NO2 (đktc). Xác định phần trăm khối lượng của mỗi kim loại trong hỗn hợp?
Lời giải:
Gọi nAl = x (mol), nCu = y (mol); nNO2 = = 0,2 mol
Theo pt: nNO2(1) = 3. nAl = 3.x mol
nNO2(2) = 2. nCu = 2y mol
⇒ Tổng nNO2 = 3x + 2y = 0,2 mol
Ta có hệ phương trình
Bài 8 (trang 62 SGK Hóa 11)
Cho 6,00 g P2O5 vào 25,0 ml dung dịch H3PO4 6,00% (D = 1,03 g/ml). Tính nồng độ phần trăm H3PO4 trong dung dịch tạo thành?
Lời giải:
mdd H3PO4 = V. D = 25. 1,03 = 25,75g
mH3PO4(sau phản ứng) = 1,545 + 8,282 = 9,827(g)
Khối lượng dung dịch sau phản ứng = 25,75 + 6 = 31,75(g)
Bài 9 (trang 62 SGK Hóa 11)
Cần bón bao nhiêu kg phân đạm amoni nitrat chứa 97,5% NH4NO3 cho 10,0 hecta khoai tây, biết rằng 1,00 hecta khoai tây cần 60,0 kg nitơ?
Lời giải:
10ha khoai tây cần 60. 10 = 600 kg nitơ
Bảo toàn nguyên tố Nito:
⇒ 1 mol (80g) NH4NO3 tạo thành 1 mol (28g)N2
Lượng NH4NO3 cần để có 600kg N2 là
Phân đạm amoni nitrat chứa 97,5% NH4NO3 nên lượng phân đạm cần bón là:
Trắc nghiệm Hóa học 11 Bài 13 có đáp án
Bài 1: Để phân biệt các mẫu phân bón sau : (NH4)2SO4, NH4Cl và Ca(H2PO4)2 cần dùng thuốc thử là
A. dung dịch BaCl2.
B. dung dịch Ba(OH)2.
C. dung dịch HCl.
D. dung dịch NaOH.
Lời giải
Đáp án: B
Bài 2: Cho các mệnh đề sau:
(1) Amoniac được dùng để điều chế nhiên liệu cho tên lửa.
(2) NO2 vừa có tính oxi hóa vừa có tính khử.
(3) Trong phòng thí nghiệm , HNO3 được điều chế bằng cách đun nóng NaNO3 tinh thể với dung dịch H2SO4 đặc.
(4) Trong công nghiệp, photpho được sản xuất bằng cách nung nóng hỗn hợp quặng photphoric, cát và than cốc ở 1200oC trong lò điện.
(5) Phân supephotphat đơn có thành phần chính là Ca(H2PO4)2.
Trong các mênh đề trên, số mệnh đề đúng là
A 4.
B. 5.
C. 2.
D. 3.
Lời giải
Đáp án: A
Bài 3: Cho sơ đồ sau : X + H2O → H3PO4.
Số chất X thỏa mãn là
A. 1.
B. 4.
C. 2.
D. 3.
Lời giải
Đáp án: D
Bài 4: Cho 2,64 gam (NH4)2SO4 tác dụng với dung dịch NaOH dư đun nóng thu được một sản phẩm khí. Hấp thụ hoàn toàn lượng khí trên vào dung dịch chứa 3,92 gam H3PO4. Muối thu được là
A. NH4H2PO4.
B. (NH4)2HPO4.
C. (NH4)3PO4.
D. NH4H2PO4.và (NH4)2HPO4.
Lời giải
Đáp án: A
nNH3 = 2n(NH4)2SO4 = 0,02 mol
nH3PO4 = 0,04 mol
nNH3 : nH3PO4 = 1 : 2 ⇒ tạo muối NH4H2PO4
Bài 5: Cho hỗn hợp X gồm Fe, FeO, Fe3O4 có khối lượng 4,04 gam phản ứng hết với dung dịch HNO3 dư thu được 336 ml NO (sản phẩm khử duy nhất (đktc)). Số mol axit tham gia phản ứng là
A. 0,06 mol.
B. 0,0975 mol.
C. 0,18 mol.
D. 0,125 mol.
Lời giải
Đáp án: C
Bài 6: Cho m gam hỗn hợp X gồm Al và Mg tác dụng hết với dung dịch HCl dư tạo ra 8,96 lít khí H2 (đktc). Cũng m gam hỗn hợp X tác dụng với dung dịch HNO3 loãng dư tạo ra 5,75 gam hỗn hợp khí Y gồm NO và N2O dung dịch thu được sau phản ứng chỉ có hai muối. Thể tích của hỗn hợp Y (đktc) là
A. 8,96 lít.
B. 3,36 lít.
C. 7,28 lít.
D. 3,64 lít.
Lời giải
Đáp án: D
nNO = x mol; nN2O = y mol;
⇒ 30x + 44y = 5,75 g (1)
Bảo toàn e ta có: ne cho = ne nhận = 2nH2 = 0,8mol
⇒ 3x + 8y = 0,8 (2)
Từ (1)(2) ⇒ x = 0,1 mol; y = 0,0625 mol ⇒ VY = 3,64 lít
Bài 7: Nung 6,58 gam Cu(NO3)2 trong bình kín, sau một thời gian thu được 4,96 gam chất rắn và hỗn hợp khí X. Hấp thụ hoàn toàn hỗn hợp X vào nước được 300 ml dung dịch Y. pH của dung dịch Y là
A. 2,0.
B. 1,7.
C. 1,3.
D. 1,0.
Lời giải
Đáp án: D
2Cu(NO3)2 –H = 80%→ 2CuO + 4NO2 (4x) + O2 (x mol)
mc/rắn giảm = mkhí = 6,58 – 4,96 = 1,62 gam ⇒ mNO2 + mO2 = 1,62
- 4x + 32x = 1,62 ⇒ x = 0,0075 mol
nNO2 = nHNO3 = nH+ = 0,03 ⇒ [H+] = 0,1 ⇒ pH = 1,0
Bài 8: Supephotphat đơn được điều chế từ một loại bột quặng chứa 73% Ca(PO4)2, 26% CaCO3 và 1% SiO2. Khối lượng dung dịch H2SO4 65% tác dụng với 100kg quặng kẽm khi điều chế supephotphat đơn là
A. 110,2 kg.
B. 106,5 kg.
C. 74,7 kg.
D. 71,0 kg.
Lời giải
Đáp án: A
nCa3(PO4)2 = 0,235 kmol; nCaCO3 = 0,26Kmol
Điều chế supephotphat đơn: nH2SO4 = 2 nCa3(PO4)2 + nCaCO3 = 0,73 kmol
⇒ mdd = 0,73. 98 : 65% = 110,2 kg
Bài 9: Cho a mol P2O5 vào 200ml dung dịch NaOH thì thu được dung dịch chúa 0,15 mol Na2HPO4 và 0,25 mol NaH2PO4. Giá trị của a và nồng độ mol của NaOH là
A. a = 0,2 và CM= 2,75M
B. a = 0,4 và CM= 2,75M.
C. a = 0,4 và CM= 5,5M.
D. a = 0,2 và CM= 5,5M.
Lời giải
Đáp án: A
Bảo toàn nguyên tố:
nP2O5 = 1/2. nNa2HPO4 + 1/2. nNaH2PO4 = 0,2 mol = a
nNaOH = 2nNa2HPO4 + nNaH2PO4 = 0,55 mol ⇒ CM NaOH = 2,75 mol
Bài 10: Thủy phân hoàn toàn 4,878 gam halogenua của photpho thu được hỗn hợp hai axit. Để trung hòa hoàn toàn hỗn hợp này cần 90 ml dung dịch NaOH 1M. Halogen đó là
A. F.
B. Cl.
C. Br.
D. I.
Lời giải
Đáp án: C
PX3 (x) + 3H2O → 3HX (3x) + H3PO3 (x mol)
nNaOH = nHX + 2nH3PO3 = 5x = 0,09 mol (axit H3PO3 là axit 2 nấc )
⇒ x = 0,018 mol
⇒ PX3 = 4,878 : 0,018 = 271 ⇒ X = 80 (Br)
Bài 11: Cho các phản ứng sau:
(1) Cu(NO3)2
(2) NH4NO2
(3) NH3 + O2
(4) NH3 + Cl2
(5) NH4Cl
(6) NH3 + CuO
Trong các phản ứng trên, những phản ứng tạo ra khí N2 là
A. (2),(4),(6).
B. (3),(5),(6).
C. (1),(3),(4).
D. (1),(2),(5).
Lời giải
Đáp án: A
Bài 12: Cho các phản ứng sau:
(1) NH4Cl
(2) NH4NO3
(3) NH4NO2 + NaOH
(4) Cu + HCl + NaNO3
(5) (NH4)2CO3
Trong các phản ứng trên, số phản ứng tạo thành khí NH3 là
A. 2.
B. 3.
C. 4.
D. 5.
Lời giải
Đáp án: A
Bài 13: Cho 2 muối X, Y thỏa mãn điều kiện sau:
X + Y → không xảy ra phản ứng.
X + Cu → không xảy ra phản ứng.
Y + Cu → không xảy ra phản ứng.
X +Y + Cu → xảy ra phản ứng.
X và Y là:
A. Mg(NO3)2và KNO3
B. Fe(NO3)3 và NaHSO4.
C…NaNO3và NaHCO3
D. NaNO3 và NaHSO4.
Lời giải
Đáp án: D
Bài 14: Axit nitric và axit photphoric có cùng phản ứng với nhóm các chất nào sau đây?
A. NaOH, K2CO3, CuCl2, NH3.
B. NaOH, K2HPO4, Na2CO3, NH3.
C. NaOH, Na2CO3,KCl, K2S.
D. KOH, MgO, CuSO4, NH3.
Lời giải
Đáp án: B
Bài 15: Để phân biệt các dung dịch axit HCl, HNO3, H2SO4 và H3PO4, người ta dùng thêm kim loại nào sau đây?
A. Cu.
B. Na.
C. Ba.
D. Fe.
Lời giải
Đáp án: C
Bài 16: Có các dung dịch sau : HCl, H3PO4, NaH2PO4, NaH2PO4và Na3PO4. Trộn các dung dịch đó với nhau theo từng đôi một, số cặp xảy ra phăn ứng là
A. 6.
B. 4.
C. 7
D. 5.
Lời giải
Đáp án: A
******************
Trên đây là nội dung bài học Hóa học 11 Bài 13: Luyện tập: Tính chất của nitơ, photpho và các hợp chất của chúng do THPT Ngô Thì Nhậm biên soạn bao gồm phần lý thuyết, giải bài tập và các câu hỏi trắc nghiệm có đáp án đầy đủ. Hy vọng các em sẽ nắm vững kiến thức về Luyện tập: Tính chất của nitơ, photpho và các hợp chất của chúng. Chúc các em học tập thật tốt và luôn đạt điểm cao trong các bài thi bài kiểm tra trên lớp.
Biên soạn bởi: Trường THPT Ngô Thì Nhậm
Chuyên mục: Hoá học 11