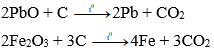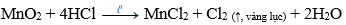Hóa học 9 Bài 27: Cacbon được THPT Ngô Thì Nhậm biên soạn hy vọng sẽ là là tài liệu hữu ích giúp các em nắm vững kiến thức bài học và đạt kết quả tốt trong các bài thi, bài kiểm tra trên lớp.
Tóm tắt lý thuyết Hóa học 9 Bài 27
I. CÁC DẠNG THÙ HÌNH CỦA CACBON
– Dạng thù hình của một nguyên tố hóa học là những đơn chất khác nhau do nguyên tố đó tạo nên.
Ví dụ: oxi (O2), ozon (O3) là hai dạng thù hình của nguyên tố oxi.
– Nguyên tố cacbon có 3 dạng thù hình là:
+ Kim cương: cứng, trong suốt, không dẫn điện.
+ Than chì: mềm, dẫn điện.
+ Cacbon vô định hình (than đá, than gỗ, than xương, …): xốp, không dẫn điện.
II. TÍNH CHẤT CỦA CACBON
1. Tính chất hấp phụ
– Than gỗ có khả năng giữ trên bề mặt của nó các chất khí, chất hơi, chất tan trong dung dịch. Than gỗ có tính hấp phụ
– Than hoạt tính có tính hấp phụ cao được dùng để làm trắng đường, chế tạo mặt nạ phòng độc…
2. Tính chất hóa học
Cacbon có những tính chất hóa học của phi kim. Tuy nhiên cacbon là phi kim hoạt động yếu.
Dưới đây là hai tính chất hóa học có nhiều ứng dụng trong thực tế của cacbon:
a) Tác dụng với oxi tạo thành cacbon đioxit CO2 (C là chất khử)
Phương trình hóa học:
Phản ứng tỏa nhiều nhiệt, do đó C được dùng làm nhiên liệu trong sản xuất và đời sống
b) Tác dụng với oxit kim loại tạo thành CO2 và kim loại
Ở nhiệt độ cao, C khử được một số oxit kim loại như PbO, ZnO,…thành kim loại.
Ví dụ:
Trong luyện kim người ta sử dụng tính chất này của cacbon để điều chế kim loại.
III. ỨNG DỤNG CỦA CACBON
Tùy thuộc vào tính chất của mỗi dạng thù hình, người ta sử dụng cacbon trong đời sống, sản xuất và trong kĩ thuật.
Ví dụ:
– Than chì được dùng làm điện cực, chất bôi trơn, ruột bút chì…
– Kim cương được dùng làm đồ trang sức quý hiếm, mũi khoan, dao cắt kính…
– Cacbon vô định hình dùng làm mặt nạ phòng độc, chất khử mùi…
Giải bài tập SGK Hóa học 9 Bài 27
Bài 1 (trang 84 SGK Hóa 9)
Dạng thù hình của nguyên tố là gì? Cho hai ví dụ.
Lời giải:
– Dạng thù hình của nguyên tố là những đơn chất khác nhau do cùng một nguyên tố hóa học tạo nên.
– Một nguyên tố hóa học có thể tạo ra hai hay nhiều đơn chất. Ví dụ:
Cacbon có ba dạng thù hình: kim cương, than chì, cacbon vô định hình.
Photpho có ba dạng thù hình: photpho trắng, photpho đỏ và photpho đen.
Bài 1 (trang 84 SGK Hóa 9)
Viết phương trình hóa học của cacbon với các oxit sau:
a) CuO.
b) PbO.
c) CO2.
d) FeO.
Hãy cho biết loại phản ứng: vai trò của C trong các phản ứng, ứng dụng của các phản ứng đó trong sản xuất.
Lời giải:
Phương trình hóa học của phản ứng:
a) 2CuO + C 2Cu + CO2
b) 2PbO + C 2Pb + CO2
c) CO2 + C 2CO
d) 2FeO + C 2Fe + CO2
Trong các phản ứng trên cacbon là chất khử.
– Ứng dụng của cacbon:
Tùy thuộc vào tính chất mỗi dạng thù hình, người ta sử dụng cacbon trong đời sống, sản xuất, kĩ thuật.
– Ví dụ: Than chì được dùng làm điện cực, chất bôi trơn, ruột bút chì. Kim cương dùng làm đồ trang sức, mũi khoan, sao cắt hình.
Than đá, than gỗ được dùng làm nhiên liệu trong công nghiệp, chất khử để điều chế một số kim loại kém hoạt động.
Bài 3 (trang 84 SGK Hóa 9)
Hãy xác định công thức hóa học thích hợp của A, B, C, D trong thí nghiệm ở hình vẽ bên.
Nêu hiện tượng thí nghiệm và viết phương trình hóa học.
Lời giải:
Công thức hóa học thích hợp của các chất:
A: CuO;
B: C (cacbon);
C: CO2;
D: dung dịch Ca(OH)2.
Khí CO2 sinh ra làm vẩn đục nước vôi trong và tạo kết tủa CaCO3.
Phương trình hóa học của các phản ứng:
2CuO + C 2Cu + CO2 ↑
CO2 + Ca(OH)2 → CaCO3 ↓ + H2O.
Bài 4 (trang 84 SGK Hóa 9)
Tại sao sử dụng than để đun nấu, nung gạch ngói, nung vôi gây ô nhiễm môi trường. Hãy nêu biện pháp chống ô nhiễm môi trường và giải thích.
Lời giải:
Khi đốt cháy than làm cho lượng oxi giảm đồng thời sản phẩm sinh ra là khí CO2, CO, SO2 gây độc cho con người, gây mưa axit, hiệu ứng nhà kính, nên có ảnh hưởng rất lớn đến sức khỏe con người. Do đó, nên xây lò ỏ những khu xa dân cư, thoáng mát, đồng thời tăng cường trồng cây xanh để giúp hấp thụ khí CO2 và giải phóng khí oxi.
Bài 5 (trang 84 SGK Hóa 9)
Trong công nghiệp, người ta sử dụng cacbon để làm nhiên liệu. Tính nhiệt lượng tỏa ra khi đốt cháy 5kg than đá chứa chứa 90% cacbon, biết rằng 1 mol cacbon cháy thì tỏa ra 394kJ.
Lời giải:
Khối lượng cacbon: 5 x 90% = 4,5 (kg)
1 mol C (12g) khi đốt cháy tỏa ra 394 (kJ)
Vậy 4,5kg = 4500g C khi đốt cháy tỏa ra x (kJ).
Nhiệt lượng tỏa ra khi đốt cháy 5kg là:
Trắc nghiệm Hóa học 9 Bài 27 (có đáp án)
Câu 1: Dạng thù hình của một nguyên tố là
A. những đơn chất khác nhau do nguyên tố đó tạo nên.
B. những chất khác nhau do từ hai nguyên tố hoá học trở lên tạo nên.
C. những chất khác nhau được tạo nên từ cacbon.
D. những chất khác nhau được tạo nên từ nguyên tố phi kim với oxi.
Đáp án: A
Câu 2: Các dạng thù hình của cacbon là
A. than chì, cacbon vô định hình, khí cacbonic.
B. than chì, kim cương, canxi cacbonat.
C. cacbon, cacbon oxit; cacbon ddioxxit.
D. kim cương, than chì, cacbon vô định hình.
Đáp án: D
Câu 3: Do có tính hấp phụ, nên cacbon vô định hình được dùng làm
A. điện cực, chất khử.
B. trắng đường, mặt nạ phòng hơi độc.
C. ruột bút chì, chất bôi trơn.
D. mũi khoan, dao cắt kính.
Đáp án: B
Câu 4: Chất nào sau đây khi cháy tạo ra oxit ở thể khí ?
A. Kali.
B. Silic.
C. Cacbon.
D. Natri.
Đáp án: C
Câu 5: Dãy oxit phản ứng với cacbon ở nhiệt độ cao tạo thành đơn chất kim loại là
A. CuO, BaO, Fe2O3.
B. PbO, CuO, FeO.
C. Fe2O3, PbO, Al2O3.
D. K2O, ZnO, Fe3O4.
Đáp án: B
C khử được oxit của các kim loại đứng sau Al trong dãy hoạt động hóa học thành kim loại.
Câu 6: Để có thể nhận biết 3 lọ mất nhãn, mỗi lọ đựng một chất rắn màu đen là: bột than, bột đồng (II) oxit và bột mangan đioxit, ta dùng
A. dung dịch HCl đặc, nóng.
B. dung dịch NaCl.
C. dung dịch CuSO4.
D. nước nóng.
Đáp án: A
Sử dụng dung dịch HCl đặc, nóng.
+ chất rắn tan dần, có khí màu vàng lục, mùi xốc thoát ra → mangan đioxit (MnO2)
+ chất rắn tan dần, sau phản ứng thu được dung dịch màu xanh → đồng (II) oxit (CuO)
CuO + 2HCl → CuCl2 (xanh) + H2O
+ không có hiện tượng gì xuất hiện → cacbon.
Câu 7: Đốt cháy hoàn toàn 12 gam C thì thể tích tối đa của khí CO2 thu được ở đktc là
A. 1,12 lít.
B. 11,2 lít.
C. 2,24 lít.
D. 22,4 lít.
Đáp án: D
Số mol cacbon: nC = 12 : 12 = 1 mol
→ Thể tích CO2: V = 1.22,4 = 22,4 lít.
Câu 8: Khối lượng C cần dùng để khử hoàn toàn 8 gam CuO thành kim loại là
A. 3,6 gam.
B. 1,2 gam.
C. 2,4 gam.
D. 0,6 gam.
Đáp án: D
Số mol CuO: nCuO = 8 : 80 = 0,1 mol
→ mC pư = 0,05.12 = 0,6 gam.
Câu 9: Thể tích cacbon đioxit (đktc) thu được khi đốt cháy hoàn toàn 1 tấn than chứa 8% tạp chất là
A. 1717,3 m3
B. 1715,3 m3
C. 1710,3 m3
D. 1708 m3
Đáp án: A
%C có trong than là 100% – 8% = 92%
Khối lượng C có trong 1 tấn than là:
→ VCO2 = nCO2.22,4 = nC.22,4 = 76 666,67.22,4 = 1717333,408 lít
≈ 1717,33 m3.
Câu 10: Đốt cháy hoàn toàn 45g cacbon cần dùng V lít không khí (đktc). Biết Vkk = 5VO2 và sản phẩm tạo thành chỉ có cacbonđioxit.
A. 450 lít.
B. 425 lít.
C. 420 lít.
D. 400 lít.
Đáp án: C
Số mol cacbon: nC = 45 : 12 = 3,75 mol
Thể tích khí O2 cần dùng: VO2 = 3,75.22,4 = 84 lít
→ Thể tích không khí cần dùng: Vkk = 5.84 = 420 lít.
******************
Trên đây là nội dung bài học Hóa học 9 Bài 27: Cacbon do THPT Ngô Thì Nhậm biên soạn bao gồm phần lý thuyết, giải bài tập và các câu hỏi trắc nghiệm có đáp án đầy đủ. Hy vọng các em sẽ nắm vững kiến thức về Cacbon. Chúc các em học tập thật tốt và luôn đạt điểm cao trong các bài thi bài kiểm tra trên lớp.
Biên soạn bởi: Trường THPT Ngô Thì Nhậm
Chuyên mục: Hoá học 9