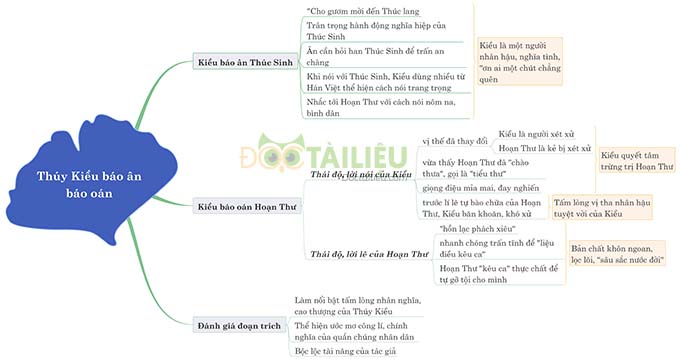
Hóa học 11 Bài 8: Amoniac và muối amoni – Giải bài tập SGK Hóa học 11 Bài 8
Hóa học 11 Bài 8: Amoniac và muối amoni được THPT Ngô Thì Nhậm biên soạn hy vọng sẽ là là tài liệu hữu ích giúp các em nắm vững kiến thức bài học và đạt kết quả tốt trong các bài thi, bài kiểm tra trên lớp.
Tóm tắt lý thuyết Hóa học 11 Bài 8
AMONIAC
I. Cấu tạo phân tử
Hình 1: Sơ đồ cấu tạo và mô hình cấu tạo của phân tử NH3.
– Trong phân tử NH3, N liên kết với ba nguyên tử hiđro bằng ba liên kết cộng hóa trị có cực.
– Những đôi electron dùng chung bị lệch về phía nguyên tử N có độ âm điện lớn hơn.
– Phân tử NH3 có cấu tạo hình chóp với nguyên tử nitơ ở đỉnh, đáy là một tam giác mà đỉnh là ba nguyên tử H.
– Nitơ còn một cặp electron hóa trị là nguyên nhân gây ra tính bazơ của NH3.
II. Tính chất vật lý
– Amoniac (NH3) là chất khí không màu, có mùi khai và xốc, nhẹ hơn không khí, tan rất nhiều trong nước.
– Ở điều kiện thường, 1 lít nước có hòa tan 800 lít amoniac.
Hình 2: Sự hòa tan của amoniac trong nước
– Hòa tan NH3 vào nước thu được dung dịch gọi là dung dịch amoniac. Dung dịch amoniac đậm đặc thường dùng trong phòng thí nghiệm có nồng độ 25% (D = 0,91g/cm3).
III. Tính chất hóa học
1. Tính bazơ yếu
a) Tác dụng với nước
NH3 + H2O ⇄ NH4++OH-
⇒ Dung dịch NH3 là một dung dịch bazơ yếu.
⇒ Có thể dùng quỳ tím ẩm để nhận biết khí amoniac, quỳ tím ẩm sẽ chuyển thành màu xanh.
b) Tác dụng với dung dịch muối
– Dung dịch amoniac có thể tác dụng với dung dịch muối của nhiều kim loại, tạo thành kết tủa hiđroxit của các kim loại đó.
AlCl3+3NH3+3H2O →Al(OH)3↓+3NH4Cl
Al3++3NH3+3H2O→ Al(OH)3↓+3NH4
c) Tác dụng với axit → muối amoni:
NH3 + HCl → NH4Cl (amoni clorua)
2NH3 + H2SO4 → (NH4)2SO4 (amoni sunfat)
2. Tính khử
– Amoniac có tính khử: phản ứng được với oxi, clo và khử một số oxit kim loại.
a) Tác dụng với oxi
NH3 cháy trong khí oxi cho ngọn lửa màu vàng, tạo ra khí nitơ và hơi nước.
4NH3 + 3O2 2N2 + 6H2O
4NH3 + 5O2 C4NO + 6H2O
Hình 3: Khí amoniac cháy trong oxi
b) Tác dụng với clo
– Clo oxi hóa mạnh amoniac tạo ra nitơ và hiđro clorua:
2NH3 + 3Cl2 → N2 + 6HCl
– NH3 kết hợp ngay với HCl vừa sinh ra tạo “khói trắng” NH4Cl.
NH3 + HCl → NH4Cl
IV. Ứng dụng
– Sản xuất axit nitric, các loại phân đạm như urê (NH2)2CO; NH4NO3; (NH4)2SO4; …
Hình 4: Một số loại đạm
– Điều chế hiđrazin (N2H4) làm nhiên liệu cho tên lửa.
– Amoni lỏng dùng làm chất gây lạnh trong thiết bị lạnh.
V. Điều chế
1. Trong phòng thí nghiệm
– Điều chế bằng cách đun nóng muối amoni (ví dụ NH4Cl) với Ca(OH)2.
Phương trình hóa học:
2NH4Cl + Ca(OH)2CaCl2 + 2NH3↑ + 2H2O
Hình 4: Điều chế khí amoniac trong phòng thí nghiệm
Lưu ý:
– Để làm khô khí, người ta cho khí amoniac vừa tạo thành có lẫn hơi nước đi qua bình đựng vôi sống (CaO).
– Khi muốn điều chế nhanh 1 lượng nhỏ khí NH3, người ta thường đun nóng dung dịch amoniac đậm đặc.
2. Trong công nghiệp
– Tổng hợp từ nitơ và hiđro, theo phản ứng:
N2 + 3H2 2NH3 ∆H<0
– Điều kiện áp dụng:
+ Nhiệt độ: 450 – 500oC.
+ Áp suất cao từ 200 – 300 atm.
+ Chất xúc tác: sắt kim loại được trộn thêm Al2O3, K2O, …
– Làm lạnh hỗn hợp khí bay ra, NH3 hóa lỏng được tách riêng.
MUỐI AMONI
– Là tinh thể ion gồm cation và anion gốc axit.
Thí dụ: NH4Cl (amoni clorua), NH4NO3 (amoni nitrat).
I. Tính chất vật lý
– Tất cả các muối amoni đều tan nhiều trong nước.
– Khi tan trong nước, điện li hoàn toàn thành các ion.
NH4Cl →NH4++ Cl–
1. Tác dụng với dung dịch kiềm
– Dung dịch đậm đặc của muối amoni phản ứng với dung dịch kiềm khi đun nóng sinh ra khí amoniac.
Thí dụ:
NH4Cl + NaOH NH3↑ + NaCl + H2O
Phương trình ion rút gọn là:
++OH-→ NH3↑ + H2O
→ Phản ứng này để nhận biết ion amoni và điều chế amoniac trong phòng thí nghiệm.
2. Phản ứng nhiệt phân
Bạn đang xem: Hóa học 11 Bài 8: Amoniac và muối amoni – Giải bài tập SGK Hóa học 11 Bài 8
Các muối amoni dễ bị phân hủy bởi nhiệt.
– Muối amoni chứa gốc của axit không có tính oxi hóa khi nung nóng bị phân hủy thành NH3.
Thí dụ:
NH4Cl (r)NH3↑ + HCl↑
Hình 5: Sự phân hủy của NH4Cl
– Các muối amoni cacbonat và amoni hiđrocacbonat bị phân hủy dần dần ngay ở nhiệt độ thường, khi đun nóng thì phản ứng xảy ra nhanh hơn.
(NH4)2CO3 (r)NH3↑ + NH4HCO3 (r)
NH4HCO3 (r)NH3↑ + CO2↑ + H2O
Lưu ý: NH4HCO3 (bột nở) được dùng làm xốp bánh.
– Muối amoni chứa gốc của axit có tính oxi hóa như axit nitrơ, axit nitric khi bị nhiệt phân cho ra N2, N2O.
Thí dụ:
NH4NO2N2 + 2H2O
NH4NO3N2O + 2H2O
⇒ Những phản ứng này được sử dụng để điều chế các khí N2 và N2O trong phòng thí nghiệm.
Giải bài tập SGK Hóa học 11 Bài 8
Bài 1 (trang 37 SGK Hóa 11)
Mô tả và giải thích hiện tượng xảy ra trong thí nghiệm chứng minh rằng amoniac tan nhiều trong nước?
Lời giải:
– Thí ngiệm:
– Khí amoniac được nạp vào đầy bình thuỷ tinh, đạy bình bằng nút cao su có ống thuỷ tinh nhọn xuyên qua.
– Nhúng đầu ống thuỷ tinh vào chậu nước có pha vài giọt phenolphtalein.
– Hiện tượng: Nước dâng lên rất nhanh trong ống thuỷ tinh nhọn sau đó phun lên có tia màu hồng
– Giải thích: Khí amoniac tan rất nhanh trong nước là giảm áp suất trong bình nên áp suất ngoài không khí nén vào mặt thoáng của chậu nước làm nước phun lên trong ống thuỷ tinh thành dòng. Amoniac tan trong nước tạo thành dung dịch có tính bazơ làm cho phenolphtalein không màu chuyển thành màu hồng.
Bài 2 (trang 37 SGK Hóa 11)
Hoàn thành sơ đồ chuyển hóa sau và viết các phương trình hóa học:
Biết rằng A là hợp chất của nitơ.
Lời giải:
– Sơ đồ:
Phương trình phản ứng:
(1) Khí NH3 + H2O ⇆ NH4OH
(2) NH3 + HCl → NH4Cl
(3) NH4Cl + NaOH → NH3↑ + NaCl + H2O
(4) NH3 + HNO3 → NH4NO3
(5) NH4NO3 → N2O + 2H2O
Bài 3 (trang 37 SGK Hóa 11)
Hiện nay, để sản xuất amoniac, người ta điều chế nitơ và hiđro bằng cách chuyển hoá có xúc tác một hỗn hợp gồm không khí, hơi nước và khí metan (thành phần chính của khí thiên nhiên). Phản ứng giữa khí metan và hơi nước tạo ra hiđro và cacbon đioxit. Để loại khí oxi và thu khí nitơ, người ta đốt khí metan trong một thiết bị kín chứa không khí.Hãy viết phương trình hoá học của phản ứng điều chế khí hiđro, loại khí oxi và tổng hợp khí amoniac?
Lời giải:
Phương trình điều chế hiđro
CH4 + 2H2O –to, xt→ CO2 + 4H2
Phương trình loại khí oxi:
CH4 + 2O2 –to→ CO2 + 2H2O
Phương trình tống hợp amoniac:
N2 + 3H2 –450-500o, Fe, 200-300atm→ 2NH3
Bài 4 (trang 38 SGK Hóa 11)
Trình bày phương pháp hoá học để phân biệt các dung dịch: NH3, Na2SO4, NH4Cl, (NH4)2SO4. Viết phương trình hoá học của các phản ứng đã dùng.
Lời giải:
Cho quỳ tím vào từng ống: ống màu xanh là dung dịch NH3; hai ống có màu hồng là NH4Cl và (NH4)2SO4; ống không có hiện tượng gì là Na2SO4.
Cho Ba(OH)2 vào hai ống làm hồng quỳ tím. Nếu thấy ống nào có khí bay ra mùi khai là NH4Cl, ống vừa có khí bay ra mùi khai vừa có kết tủa là (NH4)2SO4.
(NH4)2SO4 + Ba(OH)2 → BaSO4 ↓ + 2NH3 ↑ + 2H2O
2NH4Cl + Ba(OH)2 → BaCl2 + 2NH3 + 2H2O
Bài 5 (trang 38 SGK Hóa 11)
Muốn cho cân bằng của phản ứng tổng hợp amoniac sang phải, cần phải đồng thời:
A. Tăng áp suất và tăng nhiệt độ.
B. Giảm áp suất và giảm nhiệt độ.
C. Tăng áp suất và giảm nhiệt độ.
D. Giảm áp suất và tăng nhiệt độ.
Lời giải:
– Đáp án C.
– Phản ứng điều chế NH3:
– Sau phản ứng số mol khí giảm nên theo nguyên lí chuyển dịch cân bằng khi tăng áp suất cân bằng chuyển dịch theo chiều giảm áp suất (chiều thuận).
– Phản ứng này toả nhiệt nên khi giảm nhiệt độ cân bằng chuyển dịch theo chiều tăng nhiệt độ (chiều thuận)
Bài 6 (trang 38 SGK Hóa 11)
Trong phản ứng nhiệt phân các muối NH4NO2 và NH4NO3 số oxi hoá của nitơ biến đổi như thế nào? Nguyên tử nitơ trong ion nào của muối đóng vai trò chất khử và nguyên tử nitơ trong ion nào của muối đóng vai trò chất oxi hoá?
Lời giải:
Phản ứng nhiệt phân:
Trong hai phản ứng trên số oxi hoá của nitơ trong mỗi phản ứng đều thay đổi. Trong mỗi phân tử muối một nguyên tử nitơ có số oxi hoá tăng, một nguyên tử có số oxi hoá giảm, đây là phản ứng oxi hoá khử nội phân tử.Ở cả hai phản ứng nitơ nguyên tử trong ion NH+4 đều là chất khử (chất cho e) nitơ từ số oxi hoá -3 tăng lên 0 ở phản ứng (1) và lên +1 ở phản ứng (2).Nguyên tử nitơ trong ion NO2– và NO3– là chất oxi hoá (chất nhận e). Ở phản ứng (1) số oxi hoá của N từ +3 (trong NO2– ) xuống 0 và ở phản ứng (2) số oxi hoá của nitơ từ +5 (trong NO3–) xuống +1.
Bài 7 (trang 38 SGK Hóa 11)
Cho dung dịch NaOH dư vào 150,0 ml dung dịch (NH4)2SO4 1,00M, đun nóng nhẹ.
a. Viết phương trình hoá học ở dạng phân tử và dạng ion rút gọn?
b. Tính thể tích khí (đktc) thu được?
Lời giải:
a) 2NaOH + (NH4)2SO4 → 2NH3↑ + Na2SO4 + 2H2O
NH4+ + OH– → 2NH3↑ + H2O
b) n(NH4)2SO4 = 0,15. 1 = 0,15 mol
Theo phương trình: nNH3 = 2. n(NH4)2SO4 = 0,15. 2 = 0,3 mol
VNH3 = 0,3. 22,4 = 6,72 lít
Bài 8 (trang 38 SGK Hóa 11)
Phải dùng bao nhiêu lít khí nitơ và bao nhiêu lít khí hiđro để điều chế 17,00 gram NH3. Biết rằng hiệu suất chuyển hoá thành amoniac là 25%. Các thể tích khí được đo ở đktc.
A. 44,8 lit N2 và 134,4 lit H2
B. 22,4 lit N2 và 134,4 lit H2
C. 22,4 lit N2 và 67,2 lit H2
D. 44,8 lit N2 và 67,2 lit H2
Lời giải:
– Đáp án A
Do hiệu suất 25% nên
nN2cần dùng = 2( mol) và nH2cần dùng = 6(mol).
⇒VN2 = 2. 22,4 = 44,8 (lit) và VH2 = 22,4. 6= 134,4 (lit).
Trắc nghiệm Hóa học 11 Bài 8 có đáp án
Bài 1: X là muối khi tác dụng với dung dịch NaOH dư sinh khí mùi khai, tác dụng với dung dịch BaCl2 sinh kết tủa trắng không tan trong HNO3. X là muối nào trong số các muối sau?
A. (NH4)2CO3.
B. (NH4)2SO3.
C. NH4HSO3.
D. (NH4)3PO4.
Lời giải
Đáp án: C
Bài 2: Nhận xét nào sau đây không đúng về muối amoni?
A. Muối amoni bền với nhiệt.
B. Các muối amoni đều là chất điện li mạnh.
C. Tất cả các muối amoni đều tan trong nước.
D. Các muối amoni đều bị thủy phân trong nước.
Lời giải
Đáp án: A
Bài 3: Oxi hóa 6 lít NH3 (tạo ra N2 và NO theo tỉ lệ mol 1 : 4) cần vừa đủ V là không khí ( chứa 20% oxi về thể tích). Các thể tích đó ở cùng điều kiện. Giá trị của V là
A. 6,5.
B. 22,5.
C. 32,5.
D. 24,5.
Lời giải
Đáp án: C
12NH3 + 13O2 → 8NO + 2N2 + 18H2O
VO2 = (6 x 13) / 12 = 6,5 mol
⇒ Vkk = 6,5 : 20% = 32,5 lít
Bài 4: Cho 22,4 lít hỗn hợp khi X gồm N2 và H2 đi qua xúc tác Fe, nung nống để tổng hợp NH3 thu được 20,16 lít hỗn hợp khí Y. Hấp thụ toàn bộ Y vào dung dịch AlCl3 dư, thu được m gam kết tủa. Các thể tích khí đó ở cùng điều kiện. Giá trị của m là
A. 13.
B. 2,6.
C. 5,2.
D. 3,9.
Lời giải
Đáp án: B
nX = 1 mol; nNH3 = nX – nY = 1- 0,9 = 0,1 mol
⇒ nAl(OH)3 = 0,1 /3 ⇒ m =2,6g
Bài 5: Thực hiện phản ứng giữa H2 và N2 (tỉ lệ mol 4 : 1) trong bình kín có xúc tác, thu được hỗn hợp khi có áp suất giảm 9% so với ban đầu(trong cùng điều kiện). HIệu suất phản ứng là
A. 20%.
B. 22,5%.
C. 25%.
D. 27%.
Lời giải
Đáp án: B
nH2 = 4 mol; nN2 = 1 mol ⇒ hỗn hợp khí có áp suất giảm 9%
⇒ Số mol sau phản ứng = 91%. 5 = 4,55 mol
3H2 (3x) + N2 (x) → 2NH3 (2x) do H2 : N2 = 4 : 1 ⇒ Hiệu suất tính theo N2
n hỗn hợp sau pư = nH2 dư + nN2 dư + nNH3 = 4 – 3x + 1 – x + 2x = 5 – 2x = 4,55
⇒ x = 0,225 ⇒ H% = 22,5%
Bài 6: Điều chế NH3 từ hỗn hợp hồm N2 và H2 (tỉ lệ 1 : 3) . Tỉ khối hỗn hợp trước so với hỗn hợp sau phản ứng là 0,9. Hiệu suất phản ứng là
A. 25%.
B. 40%.
C. 10%.
D. 20%.
Lời giải
Đáp án: D
Ta có
Áp dụng định luật bảo toàn khối lượng: msau = mtrước
→ nH2 = 7,5 mol; nN2 = 2,5 mol
3H2 (3x) + N2 (x) → 2NH3 (2x mol) do H2 : N2 = 3 : 1 ⇒ Hiệu suất tính theo N2 hoặc H2
Sau phản ứng n = nH2 + nN2 + nNH3 = 7,5 – 3x + 2,5 – x + 2x = 10 – 2x = 9
→ x = 0,5 ⇒ H% = (0,5/2,5). 100% = 20%
Bài 7: Hỗn hợp X gồm NH4Cl và (NH4)2SO4. Cho X tác dụng với dung dịch Ba(OH)2 dư, đun nhẹ thu được 9,32 gam kết tủa và 2,24 lít khí thoát ra. Hỗn hợp X có khối lượng là
A. 5,28 gam.
B. 6,60 gam.
C. 5,35 gam.
D. 6,35 gam.
Lời giải
Đáp án: D
NH4Cl (x mol); (NH4)2SO4 (y mol)
nBaSO4 = y = 0,04 mol
nNH3 = nNH4+ = x + 2y = 0,1 mol ⇒ x = 0,02 mol
mX = 0,02. 53,5 + 0,04. 132 = 6,35 gam
Bài 8: Cho 14,8 gam Ca(OH)2 vào 150 gam dung dịch (NH4)2SO4 26,4% rồi đun nóng thu được V lít khí (đktc). Để đốt cháy hết V lít khí trên cần vừa đủ một lượng O2. Lượng O2 trên thu được khi nung m gam KClO2 (có xúc tác). Giá trị của m là
A. 73,5.
B. 49.
C. 24,5.
D. 12,25.
Lời giải
Đáp án: Chưa biên soạn
Bài 9: Trộn 300 ml dung dịch NaNO2 2M với 200 ml dung dịch NH4Cl 2M rồi đun nóng cho đến khi phản ứng xảy ra hoàn toàn. Thể tích khí thu được ở đktc là
A. 22,4 lít.
B. 13,44 lít.
C. 8,96 lít.
D. 1,12 lít.
Lời giải
Đáp án: C
nNaNO2 = 0,6 mol; nNH4Cl = 0,4 mol
NH4Cl + NaNO2 –toC→ N2 + NaCl + 2H2O
nN2 = nNH4Cl = 0,4 mol ⇒ VN2 = 8,96l
Bài 10: Cho 100 gam dung dịch NH4HSO4 11,5% vào 100 gam dung dịch Ba(OH)2 13,68% và đun nhẹ. Thể tích khí (đktc) và khối lượng kết tủa thu được là (giả sử toàn bộ khí sinh ra thoát ra khỏi dung dịch)
A. 2,24 lít và 23,3 gam
B. 2,244 lít và 18,64 gam
C. 1,344 lít và 18,64 gam
D. 1,792 lít và 18,64 gam.
Lời giải
Đáp án: C
NH4HSO4 + Ba(OH)2 → BaSO4 ↓ + NH3 ↑ + H2O
HSO4– + Ba2+ → SO42- + H2O
OH– + NH4+ → NH3 + H2O
⇒ nNH3 = 0,06 mol
⇒ V = 1,344l
Ba2+ + SO42- → BaSO4
⇒ nBaSO4 = 0,08 mol
⇒ m = 18,64g
Bài 11: Tính bazơ của NH3 do
A. trên N còn cặp e tự do.
B. phân tử có 3 liên kết cộng hóa trị phân cực.
C. NH3tan được nhiều trong nước.
D. NH3tác dụng với nước tạo NH4OH.
Lời giải
Đáp án: A
Bài 12: Để tách riêng NH3 ra khỏi hỗn hợp gồm N2 , H2, NH3 trong công nghiệp người ta đã
A. Cho hỗn hợp qua nước vôi trong dư.
B. Cho hỗn hợp qua bột CuO nung nóng.
C. Nén và làm lạnh hỗn hợp để hòa lỏng NH3.
D. Cho hỗn hợp qua dung dịch H2SO4 đặc.
Lời giải
Đáp án: C
Bài 13: Chất nào sau đây có thể làm khô khí NH3 có lẫn hơi nước?
A. P2O5.
B. H2SO4 đặc.
C. CuO bột.
D. NaOH rắn.
Lời giải
Đáp án: D
Bài 14: Trong các phản ứng sau, phản ứng nào NH3 đóng vai trồ là chất oxi hóa?
A. 2NH3+ H2O2+MnSO4 → MnO2 + (NH4)2SO4
B. 2NH3+ 3Cl2→ N2 + 6HCl
C. 4NH3+ 5O2→ 4NO + 6H2O
D. 2HN3+ 2 Na → 2NaNH2+ H2
Lời giải
Đáp án: D
Bài 15: Muối được làm bột nở trong thực phẩm là
A. (NH4)2CO3.
B. Na2CO3.
C. NH4HSO3.
D. NH4Cl.
Lời giải
Đáp án: C
Bài 16: Dãy các chất đều phản ứng với NH3 trong điều kiện thích hợp là:
A. HCl, O2, Cl2, FeCl5.
B. H2SO4, Ba(OH)2, FeO, NaOH
C. HCl, HNO3, AlCl3, CaO
D. KOH, HNO3, CuO, CuCl2
Lời giải
Đáp án: A
******************
Trên đây là nội dung bài học Hóa học 11 Bài 8: Amoniac và muối amoni do THPT Ngô Thì Nhậm biên soạn bao gồm phần lý thuyết, giải bài tập và các câu hỏi trắc nghiệm có đáp án đầy đủ. Hy vọng các em sẽ nắm vững kiến thức về Amoniac và muối amoni. Chúc các em học tập thật tốt và luôn đạt điểm cao trong các bài thi bài kiểm tra trên lớp.
Biên soạn bởi: Trường THPT Ngô Thì Nhậm
Chuyên mục: Hoá học 11