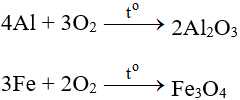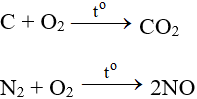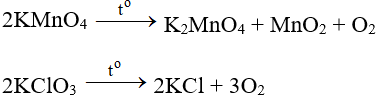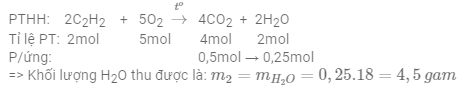Nêu tính chất hóa học của oxi – Bài tập vận dụng có đáp án
Nêu tính chất hóa học của oxi
Cấu tạo phân tử oxi
Nguyên tố oxi có số hiệu nguyên tử là 8, thuộc nhóm VIA, chu kì 2 của bảng tuần hoàn các nguyên tố hoá học.
Nguyên tử oxi có cấu hình electron là 1s22s22p4, lớp ngoài cùng có 6e.
Trong điều kiện bình thường, phân tử oxi có 2 nguyên tử liên kết với nhau bằng liên kết cộng hoá trị không cực.
Công thức cấu tạo của phân tử oxi là O=O.
Tính chất vật lý và trạng thái tự nhiên của oxi
1. Tính chất vật lý
Khí oxi không màu, không mùi, không vị, hơi nặng hơn không khí.
Dưới áp suất khí quyển, oxi hoá lỏng ở nhiệt độ -183oC.
Khí oxi tan ít trong nước (100ml nước ở 20oC, 1 atm hoà tan được 3,1ml khí oxi. Độ tan của khí oxi ở 20oC và 1 atm là 0,0043 g trong 100g H2O).
2. Trạng thái tự nhiên
Oxi trong không khí là sản phẩm của quá trình quang hợp.
Tính chất hóa học của oxi
Khi tham gia phản ứng, nguyên tử O dễ dàng nhận thêm 2e. Nguyên tử oxi có độ âm điện lớn (3,44), chỉ kém flo (3,98).
Do vậy, oxi là nguyên tố phi kim hoạt động hoá học, có tính oxi hoá mạnh. Trong các hợp chất (trừ hợp chất với flo), nguyên tố oxi có số oxi hoá là -2.
Oxi tác dụng với hầu hết các kim loại (trừ Au, Pt, …) và các phi kim (trừ halogen). Oxi tác dụng với nhiều hợp chất vô cơ và hữu cơ.
1. Tác dụng với kim loại
Tác dụng với hầu hết kim loại (trừ au và Pt), cần có to tạo oxit:
2. Tác dụng với phi kim
Tác dụng với hầu hết phi kim (trừ halogen), cần có to tạo oxit:
ĐB: Tác dụng với H2 nổ mạnh theo tỉ lệ 2:1 về số mol:
3. Tác dụng với hợp chất
– Tác dụng với các chất có tính khử:
– Tác dụng với các chất hữu cơ:
Ứng dụng của oxi
Oxi có vai trò quyết định sự sống của con người và động vật.
Mỗi người mỗi ngày cần 20-30m3 không khí để thở.
Điều chế oxi
1. Trong phòng thí nghiệm
Trong phòng thí nghiệm, khí oxi được điều chế bằng cách phân huỷ những hợp chất giầu oxi và ít bền đối với nhiệt như KMnO4 (rắn), KClO3 (rắn), …
2. Trong công nghiệp
a. Từ không khí: Không khí sau khi đã loại bỏ hết hơi nước, bụi, khí cacbon đioxit, được hoá lỏng. Chưng cất phân đoạn không khí lỏng, thu được oxi. Oxi được vận chuyển trong những bình thép có dung tích 100 lít dưới áp suất 150 atm.
b. Từ nước: Điện phân nước (nước có hoà tan một ít H2SO4 hoặc NaOH để tăng tính dẫn điện của nước), người ta thu được khí oxi ở cực dương và khí hiđro ở cực âm.
Bài tập vận dụng có đáp án
Câu 1: Trong các câu sau, câu nào sai?
A. Oxi nặng hơn không khí.
B. Oxi là chất khí không màu, không mùi, không vị.
C. Oxi tan nhiều trong nước.
D. Oxi chiếm 1/5 thể tích không khí.
Lời giải:
Câu sai là: Oxi tan nhiều trong nước.
Oxi là chất khí ít tan trong nước.
Đáp án cần chọn là: C
Câu 2: Chất rắn màu vàng cháy trong bình đựng khí oxi với ngọn lửa sáng xanh, có khí không màu, mùi hắc bay ra là hiện tượng của phản ứng:
A. S + O2 SO2
B. 4P + 5O2 2P2O5
C. C + O2 CO2
D. 3Fe + 2O2 Fe3O4
Lời giải:
Chất rắn màu vàng là S, S cháy trong bình đựng khí oxi với ngọn lửa sáng xanh, có khí không màu, mùi hắc bay ra là hiện tượng của phản ứng: S + O2 SO2
Đáp án cần chọn là: A
Câu 3: Cần bao nhiêu gam oxi để đốt cháy hết 2 mol lưu huỳnh?
A. 16 gam.
B. 32 gam.
C. 64 gam.
D. 48 gam.
Lời giải:
PTHH: S + O2 SO2
Tỉ lệ PT: 1mol 1mol
Phản ứng: 2mol → 2mol
=> Khối lượng oxi cần dùng là: mO2=n.M=2.32=64gammO2=n.M=2.32=64gam
Đáp án cần chọn là: C
Câu 4: Chất nào sau đây cháy mạnh trong khí oxi, sáng chói, tạo ra các hạt nóng chảy màu nâu?
A. Fe.
B. CH4.
C. P.
D. H2.
Lời giải:
Fe cháy mạnh trong khí oxi, sáng chói, tạo ra các hạt nóng chảy màu nâu là Fe3O4
PTHH: 3Fe + 2O2 Fe3O4
Đáp án cần chọn là: A
Câu 5: Khi đốt cháy mẫu dây sắt trong bình đựng khí oxi, dây sắt cháy mạnh, sáng chói, tạo ra:
A. Các hạt nhỏ nóng chảy màu nâu đỏ là sắt (III) oxit.
B. Các hạt nhỏ nóng chảy màu đỏ là oxit sắt từ.
C. Các hạt nhỏ nóng chảy màu xám là sắt (III) oxit.
D. Các hạt nhỏ nóng chảy màu nâu đen là sắt từ oxit.
Lời giải:
3Fe + 2O2 Fe3O4 (oxit sắt từ)
Đáp án cần chọn là: B
Câu 6: Người ta điều chế oxi trong phòng thí nghiệm bằng cách nào sau đây?
A. Chưng cất phân đoạn không khí lỏng.
B. Điện phân nước.
C. Điện phân dung dịch NaOH.
D. Nhiệt phân KClO3 với xúc tác MnO2.
Lời giải:
– O2 điều chế bằng phản ứng phân hủy những hợp chất giàu oxi và không bền nhiệt như KMnO4, KClO3, H2O2,…
2KMnO4 K2MnO4 + MnO2 + O2
2KClO3 2KCl + 3O2
Đáp án cần chọn là: D
Câu 7: Chất nào sau đây dùng để điều chế khí oxi trong công nghiệp?
A. CaCO3.
B. H2O.
C. KMnO4.
D. KClO3
Lời giải:
Điều chế khí oxi trong công nghiệp, người ta điện phân nước: 2H2O → 2H2 + O2
Đáp án cần chọn là: B
Câu 8: Đốt cháy 6,2 gam P trong bình chứa 6,72 lít khí oxi (đktc) tạo thành P2O5.
a, Chất nào còn dư,chất nào hết?
A. P còn dư, O2 phản ứng hết.
B. P hết, O2 dư.
C. Cả 2 chất vừa đủ.
D. Tất cả đều sai.
Lời giải:
Số mol của Photpho là:
Số mol oxi là:
Phương trình phản ứng: 4P + 5O2 2P2O5
Xét tỉ lệ phản ứng số mol chia cho hệ số phản ứng, ta có:
=> oxi dư, P phản ứng hết => phản ứng tính theo O
Đáp án cần chọn là: B
b, Khối lượng chất tạo thành là bao nhiêu
A. 15,4 gam.
B. 16 gam.
C. 14,2 gam.
D. 13,3 gam.
Lời giải:
Khối lượng chất tạo thành ta dựa vào số mol của Photpho, là chất phản ứng vừa đủ
4P + 5O2 2P2O5
4mol 2mol
0,2mol ?mol
Số mol P2O5 tạo thành là: nP2O5= =0,1mol
Khối lượng P2O5 tạo thành là: mP2O5=nP2O5.MP2O5=0,1.(31.2+16.5)=14,2gam
Đáp án cần chọn là: C
Câu 9: Tính số gam kali clorat cầm thiết để điều chế được 48 gam khí oxi?
A. 183,75 gam
B. 122,5 gam
C. 147 gam
D. 196 gam.
Lời giải:
Số mol khí oxi thu được là: nO2 = = 1,5 mol
PTHH: 2KClO3 2KCl + 3O2
Tỉ lệ theo PT: 2mol 3mol
Phản ứng: 1mol ← 1,5mol
=> Khối lượng KClO3 cần dùng là: mKClO3=n.M=1.(39+35,5+16.3)=122,5gam
Đáp án cần chọn là: B
Câu 10: Đốt cháy hoàn toàn 24 kg than đá có chứa 0,5% tạp chất lưu huỳnh và 1,5% tạp chất khác không cháy được. Tính thể tích khí CO2 và SO2 tạo thành (ở điều kiện tiêu chuẩn)
A. 43904 lít.
B. 49388 lít.
C. 43988 lít.
D. 44904 lít
Lời giải:
Trong than đá chứa: Cacbon (x%), lưu huỳnh (0,5%) và tạp chất khác (1,5%)
=> x = 100 – 0,5 – 1,5 = 98 (%)
=> trong 24 kg than đá chứa: 24.98% = 23,52 kg = 23520 gam cacbon; 24.0,5% = 0,12 kg = 120 gam lưu huỳnh; 24.1,5% = 0,36 kg = 360 gam tạp chất khác
=> số mol C là:nC = =1960mol
Số mol S là:nS = =3,75mol
PTHH: C + O2 CO2
Tỉ lệ PT: 1mol 1mol
Phản ứng: 1960mol → 1960mol
=> Thể tích khí CO2 sinh ra là:VCO2=22,4.1960=43904
PTHH: S + O2 SO2
Tỉ lệ PT: 1mol 1mol
Phản ứng: 3,75mol → 3,75mol
=> Thể tích khí SO2 sinh ra là:VSO2=22,4.3,75=84 lít
=> tổng thể tích khí thu được là:V=VCO2+VSO2=43904+84=43988 lít
Đáp án cần chọn là: C
Câu 11: Đốt cháy m1 gam kẽm bằng khí oxi vừa đủ, thu được 12,15 gam ZnO. Hòa tan toàn bộ lượng ZnO ở trên vào dung dịch chứa m2 gam HCl vừa đủ thu được sản phẩm là ZnCl2 và nước. Tính m1 + m2
A. 20,7 gam.
B. 10,95 gam.
C. 9,75 gam.
D. 10,35 gam
Lời giải:
Số mol ZnO thu được là: nZnO = =0,15 mol
PTHH: 2Zn + O2 2ZnO
Tỉ lệ PT: 2mol 1mol 2mol
Phản ứng: 0,15mol ← 0,15mol
=> Khối lượng Zn phản ứng là: m1 = mZn = 0,15.65 = 9,75 gam
Lấy 0,15 mol ZnO cho vào dung dịch HCl
PTHH: ZnO + 2HCl → ZnCl2 + H2O
Tỉ lệ PT: 1mol 2mol
P/ứng: 0,15mol → 0,3mol
=> Khối lượng HCl phản ứng là: mHCl = m2 = 0,3.36,5 = 10,95 gam
=> m1 + m2 = 9,75 + 10,95 = 20,7 gam
Đáp án cần chọn là: A
Câu 12: Đốt cháy hoàn toàn 32 gam khí metan (CH4) cần V lít khí oxi (đktc), thu được khí CO2 và H2O. Giá trị của V là
A. 22,4 lít.
B. 89,6 lít.
C. 44,8 lít.
D. 67,2 lít.
Lời giải:
Số mol khí CH4 là: nCH4= =2 mol
PTHH: CH4 + 2O2 CO2 + 2H2O
Tỉ lệ PT: 1mol 2mol
Phản ứng: 2mol → 4mol
=> thể tích khí oxi cần dùng là: VO2=22,4.n=22,4.4=89,6 lít
Đáp án cần chọn là: B
Câu 13: Đốt cháy hoàn toàn m1 gam khí etilen (C2H4) cần 7,392 lít khí oxi (đktc), thu được m2 gam khí CO2 và m3 gam H2O. Tính m1 + m2 + m3
A. 19,36 gam.
B. 10,59 gam.
C. 10,12 gam.
D. 16,72 gam.
Lời giải:
Số mol khí O2 là: nO2 = =0,33mol
Ta có PTHH: C2H4 + 3O2 2CO2 + 2H2O
Theo phương trình cứ 3 mol O2 thì đốt cháy hết 1 mol C2H4
Theo đầu bài………………0,33 mol O2…… = 0,11mol C2H4
Áp dụng định luật bảo toàn khối lượng ta có: m C2H4 + mO2 = mCO2 + mH2O
=> mCO2 + mH2O = 0,11.28 + 0,33.32=13,64
=> m1 + m2 + m3 = m C2H4 + mCO2 + mH2O = 13,64 + 3,08= 16,72 gam
Đáp án cần chọn là: D
Câu 14: Đốt cháy 7,8 gam khí axetilen (C2H2) trong khí oxi, thu được 11,2 lít khí CO2 (đktc) và m2 gam H2O. Giá trị m2 là
Lời giải:
Số mol khí C2H2 là: nC2H2 = =0,3mol
Số mol khí CO2 là: nCO2 = =0,5mol
Vì đầu bài cho 2 số liệu số mol của chất phản ứng C2H2 và chất sản phẩm CO2 => tính toán theo chất sản phẩm
Đáp án cần chọn là: C
Câu 15: Khí được con người sử dụng để hô hấp là:
A. H2.
B. O2.
C. N2.
D. CO2.
Lời giải:
Con người hít khí O2 vào cơ thể để hô hấp
Đáp án cần chọn là: B
********************
Đăng bởi: Trường THPT Ngô Thì Nhậm
Chuyên mục: Giáo dục