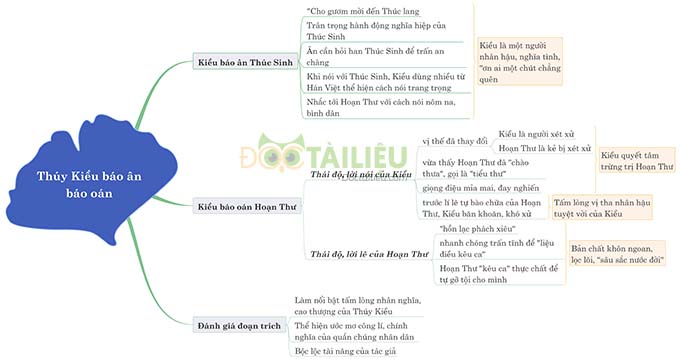
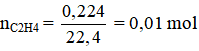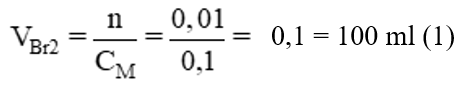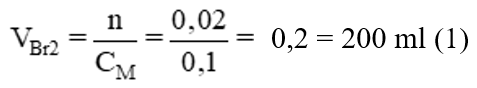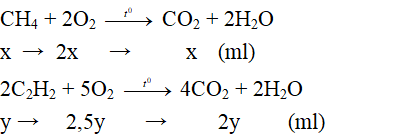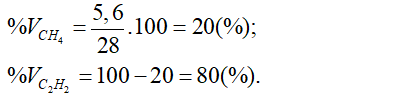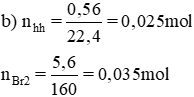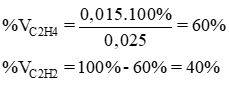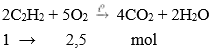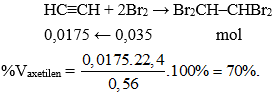Hóa học 9 Bài 38: Axetilen được THPT Ngô Thì Nhậm biên soạn hy vọng sẽ là là tài liệu hữu ích giúp các em nắm vững kiến thức bài học và đạt kết quả tốt trong các bài thi, bài kiểm tra trên lớp.
Tóm tắt lý thuyết Hóa học 9 Bài 38
Công thức phân tử axetilen: C2H2
Phân tử khối: 26
I. TÍNH CHẤT VẬT LÍ
Axetilen là chất khí, không màu, không mùi, nhẹ hơn không khí , ít tan trong nước.
II. CẤU TẠO PHÂN TỬ
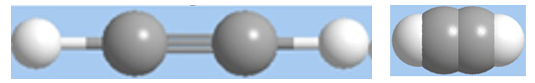
Axetien có công thức cấu tạo: H – C ≡ C– H; viết gọn HC ≡ CH.
Trong phân tử axetilen có một liên kết ba giữa hai nguyên tử cacbon.
Chú ý:
Trong liên kết ba, có hai liên kết kém bền, dễ đứt lần lượt trong các phản ứng hóa học.
Hình 1: Mô hình phân tử axetilen dạng rỗng và dạng đặc.
III. TÍNH CHẤT HÓA HỌC
1. Tác dụng với oxi
Khí axetilen cháy tỏa nhiều nhiệt, sản phẩm sinh ra gồm CO2 và nước tương tự metan và etilen.
Phương trình hóa học:
Nhận xét: Khi đốt cháy axetilen thu được số mol CO2 lớn hơn số mol H2O.
2. Phản ứng cộng với dung dịch brom
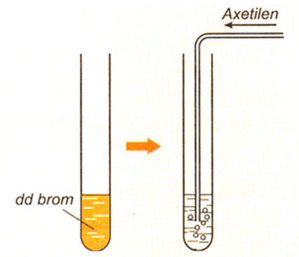
Hình 2: Mô phỏng thí nghiệm axetilen tác dụng với dung dịch brom.
Phương trình hóa học:
HC ≡ CH + Br2 → Br–CH=CH– Br
Sản phẩm mới sinh ra có liên kết đôi trong phân tử nên có thể cộng tiếp với 1 phân tử brom nữa
Br–CH=CH– Br + Br2 → Br2CH–CHBr2
Tổng quát: HC≡CH + 2Br2 → Br2CH–CHBr2
Trong điều kiện thích hợp, axetilen còn tham gia phản ứng cộng với nhiều chất khác như H2, Cl2…
IV. ỨNG DỤNG
Axetilen dùng làm nhiên liệu trong đèn xì oxi–axetilen để hàn, cắt kim loại.
Trong công nghiệp Axetilen là nguyên liệu để sản xuất poli (vinyl clorua) dùng sản xuất nhựa PVC và nhiều hóa chất khác.
V. ĐIỀU CHẾ
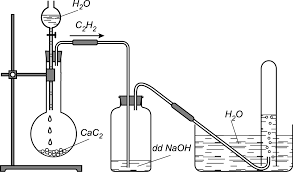
Trong phòng thí nghiệm axetilen được điều chế bằng cách cho canxi cacbua (thành phần chính của đất đèn) phản ứng với nước.
CaC2 + 2H2O → C2H2 + Ca(OH)2
Hình 3: Điều chế và thu khí axetilen trong phòng thí nghiệm
Phương pháp hiện đại để điều chế axetilen hiện nay là nhiệt phân metan ở nhiệt độ cao, sau đó làm lạnh nhanh.
Giải bài tập SGK Hóa học 9 Bài 38
Bài 1 (trang 122 SGK Hóa 9)
Hãy cho biết trong các chất sau:
CH3 – CH3 ; CH≡ CH; CH2 = CH2; CH4; CH≡ C – CH3.
a) Chát nào có liên kết ba trong phân tử?
b) Chất nào làm mất màu dung dịch brom?
Lời giải:
a) Có hai chất: CH≡ CH và CH≡ C – CH3 có liên kết ba.
b) Có ba chất làm mất màu dung dịch brom: CH≡ CH; CH2 = CH2 và CH≡ C – CH3.
Bài 2: Cần bao nhiêu ml dung dịch brom 0,1M để tác dụng vừa đủ với:
a) 0,224 lít etilen ở điều kiện tiêu chuẩn.
b) 0,224 lít axetilen ở điều kiện tiêu chuẩn.
Lời giải:
a)
C2H4 + Br2 → C2H4Br2
1 mol 1 mol 1 mol
0,01 mol ?
Theo pt: nBr2 = nC2H4 = 0,01 mol →
b)
С2H2 + 2Вr2 → C2H2Br4
1mol 2 mol 1 mol
0,01 mol ?
nBr2 = 2. nС2H2 = 0,02 (mol) →
Bài 2 (trang 122 SGK Hóa 9)
Biết rằng 0,1 lít khí etilen (đktc) làm mất màu 50ml dung dịch brom. Nếu dùng 0,1 lít khí axetilen (đktc) thì có thể làm mất màu bao nhiêu ml dung dịch brom trên?
Lời giải:
Phương trình phản ứng:
C2H4 + Br2 → C2H4Br2. (1)
C2H2 + 2Br2 → C2H2Br4. (2)
Từ phương trình (1) và (2) ta nhận thấy:
Tỉ lệ nC2H4 : nBr2 = 1:1
nC2H2 : nBr2 = 1:2
⇒ Số mol brom phản ứng tối đa với C2H2 gấp 2 lần C2H4 nên thể tích dung dịch brom cần dùng khi phản ứng với C2H2 cũng gấp 2 lần khi phản ứng với C2H4
VBr2 cần dung khi phản ứng với 0,1 l axeilen là: 50ml × 2 = 100ml.
Bài 3 (trang 122 SGK Hóa 9)
Biết rằng 0,1 lít khí etilen (đktc) làm mất màu 50ml dung dịch brom. Nếu dùng 0,1 lít khí axetilen (đktc) thì có thể làm mất màu bao nhiêu ml dung dịch brom trên?
Lời giải:
Phương trình phản ứng:
C2H4 + Br2 → C2H4Br2. (1)
C2H2 + 2Br2 → C2H2Br4. (2)
Từ phương trình (1) và (2) ta nhận thấy:
Tỉ lệ nC2H4 : nBr2 = 1:1
nC2H2 : nBr2 = 1:2
⇒ Số mol brom phản ứng tối đa với C2H2 gấp 2 lần C2H4 nên thể tích dung dịch brom cần dùng khi phản ứng với C2H2 cũng gấp 2 lần khi phản ứng với C2H4
VBr2 cần dung khi phản ứng với 0,1 l axeilen là: 50ml × 2 = 100ml.
Bài 4 (trang 122 SGK Hóa 9)
Đốt cháy 28ml hỗn hợp khí metan và axetilen cần phải dùng 67,2ml khí oxi.
a) Tính phần trăm thể tích của mỗi khí trong hỗn hợp.
b) Tính thể tích khí CO2 sinh ra.
(Các thể tích khí đo ở cùng điều kiện nhiệt độ và áp suất)
Lời giải:
Do các thể tích khí được đo ở cùng điều kiện nhiệt độ và áp suất nên tỉ lệ về thể tích cũng chính là tỉ lệ về số mol.
Gọi thể tích metan (CH4) là x (ml); thể tích axetilen (C2H2) là y (ml)
Theo bài ra: Vhh khí = 28 (ml)
→ x + y = 28 (1)
Phương trình phản ứng:
Theo bài ra thể tích khí oxi là 67,2 ml
→ 2x + 2,5y = 67,2 ml (2)
Từ (1) và (2) giải hệ phương trình được: x = 5,6 (ml) và y = 22,4 (ml).
a/ Phần trăm thể tích từng khí là:
b/ Theo phương trình phản ứng ở trên có:
Thể tích khí CO2 = x + 2y = 5,6 + 2.22,4 = 50,4 (ml).
Bài 5 (trang 122 SGK Hóa 9)
Cho 0,56 lít (đktc) hỗn hợp khí gồm C2H4, C2H2 tác dụng hết với dung dịch brom dư, lượng brom đã tham gia phản ứng là 5,6g
a) Hãy viết phương trình hóa học.
b) Tính phần trăm thể tích của mỗi khí trong hỗn hợp.
Lời giải:
a) Phương trình hóa học:
C2H4 + Br2 → C2H4Br2 (1)
C2H2 + 2Br2 → C2H2Br4 (2)
Gọi nC2H4 = x mol, nC2H2 = y.
nhh khí = x + y = 0,025.
Theo pt: nBr2(1) = nC2H4 = x mol, nBr2 (2) = 2. nC2H2= 2.y mol
⇒ nBr2 = x + 2y = 0,035.
b) Phần trăm thể tích mỗi khí:
Giải hệ phương trình ta có x = 0,015, y = 0,01.
Trắc nghiệm Hóa học 9 Bài 38 (có đáp án)
Câu 1: Trong phân tử axetilen, giữa hai nguyên tử cacbon có
A. một liên kết đơn.
B. một liên kết đôi.
C. một liên kết ba.
D. hai liên kết đôi.
Đáp án: C
Câu 2: Axetilen có tính chất vật lý nào sau đây
A. là chất khí không màu, mùi xốc, ít tan trong nước, nặng hơn không khí.
B. là chất khí không màu, không mùi, ít tan trong nước, nhẹ hơn không khí.
C. là chất khí không màu, không mùi, tan nhiều trong nước, nhẹ hơn không khí .
D. là chất khí không màu, mùi hắc, ít tan trong nước, nặng hơn không khí.
Đáp án: B
Câu 3: Khí axetilen không có tính chất hóa học nào sau đây?
A. Phản ứng cộng với dung dịch brom.
B. Phản ứng cháy với oxi.
C. Phản ứng thế với clo ngoài ánh sáng.
D. Phản ứng cộng với hiđro.
Đáp án: C
Câu 4: Phương pháp hiện đại để điều chế axetilen hiện nay là
A. nhiệt phân etilen ở nhiệt độ cao.
B. nhiệt phân benzen ở nhiệt độ cao.
C. nhiệt phân canxi cacbua ở nhiệt độ cao.
D. nhiệt phân metan ở nhiệt độ cao.
Đáp án: D
Câu 5: Một hiđrocacbon ở thể khí thường được dùng làm nhiên liệu để hàn cắt kim loại, đó là
A. metan.
B. etilen.
C. axetilen.
D. etan.
Đáp án: C
Câu 6: Dãy các chất nào sau đây đều làm mất màu dung dịch brom?
A. CH4; C6H6.
B. CH4; C2H6.
C. CH4; C2H4.
D. C2H4; C2H2.
Đáp án: D
Câu 7: Dẫn 0,1 mol khí axetilen qua bình đựng dung dịch nước brom dư. Khối lượng brom tham gia phản ứng là
A. 16,0 gam.
B. 20,0 gam.
C. 26,0 gam.
D. 32,0 gam.
Đáp án: D
→ mBrom pư = 0,2.160 = 32 gam.
Câu 8: Thể tích không khí cần dùng để đốt cháy hoàn toàn 1 mol axetilen là (các khí đo ở đktc, biết rằng oxi chiếm 20% thể tích không khí) ?
A. 300 lít.
B. 280 lít.
C. 240 lít.
D. 120 lít.
Đáp án: B
→ VO2 pư = 2,5.22,4 = 56 lít → Vkk = 56.5 = 280 lít.
Câu 9: Trong điều kiện thích hợp 1 mol khí axetilen tác dụng hoàn toàn với 2 mol khí hiđro, thu được chất khí là
A. C3H6.
B. C2H6.
C. C3H4,
D. C2H4.
Đáp án: B
C2H2 + 2H2 → C2H6
Câu 10: Cho 0,56 lít (đktc) hỗn hợp khí metan và axetilen tác dụng với dung dịch brom dư, lượng brom đã tham gia phản ứng là 5,6 gam. Thành phần phần trăm về thể tích của axetilen trong hỗn hợp ban đầu lần lượt là
A. 20%.
B. 70%.
C. 40%.
D. 60%.
Đáp án: B
Cho hỗn hợp khí qua dung dịch brom dư chỉ có axetilen phản ứng
******************
Trên đây là nội dung bài học Hóa học 9 Bài 38: Axetilen do THPT Ngô Thì Nhậm biên soạn bao gồm phần lý thuyết, giải bài tập và các câu hỏi trắc nghiệm có đáp án đầy đủ. Hy vọng các em sẽ nắm vững kiến thức về Axetilen. Chúc các em học tập thật tốt và luôn đạt điểm cao trong các bài thi bài kiểm tra trên lớp.
Biên soạn bởi: Trường THPT Ngô Thì Nhậm
Chuyên mục: Hoá học 9