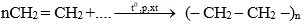Hóa học 9 Bài 37: Etilen được THPT Ngô Thì Nhậm biên soạn hy vọng sẽ là là tài liệu hữu ích giúp các em nắm vững kiến thức bài học và đạt kết quả tốt trong các bài thi, bài kiểm tra trên lớp.
Tóm tắt lý thuyết Hóa học 9 Bài 37
Etilen có công thức phân tử: C2H4
Phân tử khối: 28
I. TÍNH CHẤT VẬT LÍ
Etilen là chất khí, không màu, không mùi, nhẹ hơn không khí và ít tan trong nước.
II. CẤU TẠO PHÂN TỬ
Trong phân tử etilen mỗi nguyên tử cacbon liên kết với 2 nguyên tử H, hai hóa trị còn lại dùng để liên kết hai nguyên tử cacbon với nhau.
Etilen có công thức cấu tạo: 
Như vậy, trong phân tử etilen C2H4, có một liên kết đôi giữa hai nguyên tử cacbon.
Chú ý: Trong liên kết đôi có một liên kết kém bền. Liên kêt này dễ đứt ra trong các phản ứng hóa học.
Hình 1: Mô hình phân tử etilen dạng rỗng và dạng đặc.
III. TÍNH CHẤT HÓA HỌC
1. Tác dụng với oxi:
Khi đốt khí etilen cháy tạo thành khí CO2, hơi nước và tỏa nhiều nhiệt.
Phương trình hóa học:
Nhận xét: Khi đốt cháy khí etilen thu được số mol CO2 bằng số mol nước.
2. Tác dụng với dung dịch brom
Hình 2: Minh họa thí nghiệm etilen tác dụng với dung dịch brom.
Phương trình hóa học:
Viết gọn: CH2 = CH2 + Br2 → Br – CH2 – CH2 – Br
Nhận xét:
– Liên kết kém bền trong liên kết đôi bị đứt ra và mỗi phân tử etilen đã kết hợp thêm một phân tử brom.
– Phản ứng trên gọi là phản ứng cộng. Ngoài brom, trong những điều kiện thích hợp etilen có thể tham gia phản ứng cộng với Cl2, H2, HBr…
– Các chất có liên kết đôi như etilen dễ tham gia phản ứng cộng.
3. Các phân tử etilen kết hợp với nhau
Ở điều kiện thích hợp (nhiệt độ, áp suất, xúc tác) các phân tử etilen kết hợp với nhau tạo ra chất có kích thước và khối lượng rất lớn gọi là poli etilen (PE).
Phương trình hóa học:
Chú ý:
– Phản ứng trên là phản ứng trùng hợp.
– Poli etilen là chất không tan trong nước, không độc, là nguồn nguyên liệu quan trọng trong công nghiệp chất dẻo.
IV. ỨNG DỤNG
– Etilen dùng để điều chế axit axetic, rượu etylic, đicloetan, polime (PE, PVC)…
– Etilen dùng kích thích quả mau chín.
Giải bài tập SGK Hóa học 9 Bài 37
Bài 1 (trang 119 SGK Hóa 9)
Hãy tính số liên kết đơn, liên kết đôi giữa những nguyên tử cacbon trong phân tử các chất sau:
a) CH3 – CH3.
b) CH2 = CH2.
c) CH2 = CH – CH = CH2.
Lời giải:
a) CH3 – CH3 có 1 liên kết đơn C – C.
b) CH2 = CH2 có 1 liên kết đôi: C = C.
c) CH2 = CH – CH = CH2 có 2 liên kết đôi: C = C
1 liên kết đơn: C – C.
Bài 2 (trang 119 SGK Hóa 9)
Điền các từ thích hợp “có” hoặc “không” vào các cột sau
| Có liên kết đôi | Làm mất màu dung dịch brom | Phản ứng trùng hợp | Tác dụng với oxi | |
| Metan | ||||
| Etilen |
Lời giải:
| Có liên kết đôi | Làm mất màu dung dịch brom | Phản ứng trùng hợp | Tác dụng với oxi | |
| Metan | Không | Không | Không | Có |
| Etilen | Có 1 liên kết đôi | Có | Có | Có |
Bài 3 (trang 119 SGK Hóa 9)
Hãy nêu phương pháp hóa học loại bỏ khí etilen có sẵn trong khí metan để thu được metan tinh khiết.
Lời giải:
Dẫn hỗn hợp qua dung dịch brom dư, khi đó etilen phản ứng tạo thành đibrometan là chất lỏng ở lại trong dung dịch và chỉ có metan thoát ra.
CH2 = CH2 + Br2 → Br – CH2 – CH2 – Br.
Bài 4 (trang 119 SGK Hóa 9)
Để đốt cháy 4,48 lít khí etilen cần phải dùng:
a) Bao nhiêu lít oxi?
b) Bao nhiêu lít không khí chứa 20% thể tích oxi? Biết thể tích các khí đo ở điều kiện tiêu chuẩn.
Lời giải:
a) Phương trình phản ứng cháy etien:
C2H4 + 3O2 → 2CO2 + 2H2O.
Theo pt nO2 = 3. nC2H4 = 0,2 x 3 = 0,6 mol.
VO2 = 0,6 x 22,4 = 13,44 lít.
b) Thể tích không khí = = 67,2 lít.
Trắc nghiệm Hóa học 9 Bài 37 (có đáp án)
Câu 1: Trong phân tử etilen giữa hai nguyên tử cacbon có
A. hai liên kết đôi.
B. một liên kết đôi.
C. một liên kết đơn.
D. một liên kết ba.
Đáp án: B
Câu 2: Etilen có tính chất vật lý nào sau đây?
A. là chất khí không màu, không mùi, tan nhiều trong nước, nhẹ hơn không khí.
B. là chất khí, không màu, không mùi, ít tan trong nước, nhẹ hơn không khí.
C. là chất khí màu vàng lục, mùi xốc, ít tan trong nước, nặng hơn không khí.
D. là chất khí không màu, mùi hắc, tan trong nước, nặng hơn không khí.
Đáp án: B
Câu 3: Khi đốt cháy khí etilen thì số mol CO2 và H2O được tạo thành theo tỉ lệ
A. 2 : 1.
B. 1 : 2.
C. 1 : 3.
D. 1 : 1.
Đáp án: D
Khi đốt cháy khí etilen thu được số mol CO2 bằng số mol nước.
Câu 4: Trong quá trình chín trái cây đã thoát ra một lượng nhỏ khí nào sau đây?
A. metan.
B. etan.
C. etilen.
D. axetilen.
Đáp án: C
Câu 5: Khí CH4 và C2H4 có tính chất hóa học giống nhau là
A. tham gia phản ứng cộng với dung dịch brom.
B. tham gia phản ứng thế với brom khi chiếu sáng.
C. tham gia phản ứng trùng hợp.
D. tham gia phản ứng cháy với khí oxi sinh ra khí cacbonic và nước.
Đáp án: D
Câu 6: Khí metan có lẫn một lượng nhỏ khí etilen. Để thu được metan tinh khiết, ta dẫn hỗn hợp khí qua
A. dung dịch brom.
B. dung dịch phenolphtalein.
C. dung dịch axit clohidric.
D. dung dịch nước vôi trong.
Đáp án: A
Dẫn hỗn hợp khí qua dung dịch brom. Khí etilen phản ứng với brom bị giữ lại trong dung dịch.
CH2 = CH2 + Br2 → Br – CH2 – CH2 – Br.
Khí metan không phản ứng thoát ra khỏi dung dịch, thu được metan tinh khiết.
Câu 7: Phản ứng đặc trưng của khí etilen là
A. phản ứng cháy.
B. phản ứng thế.
C. phản ứng cộng.
D. phản ứng phân hủy.
Đáp án: C
Câu 8: Trong phòng thí nghiệm, người ta đun rượu etylic với chất xúc tác là H2SO4 đặc, ở nhiệt độ 170°C để điều chế khí X. Khí X là
A. Cl2.
B. CH4.
C. C2H4.
D. C2H2.
Đáp án: C
Câu 9: Trùng hợp 1 mol etilen (với hiệu suất 100 %) ở điều kiện thích hợp thì thu được khối lượng polietilen là
A. 7 gam.
B. 14 gam.
C. 28 gam.
D. 56 gam.
Đáp án: C
Bảo toàn khối lượng có:
mtrước = msau ⇔ mpoli etilen = metilen = 1.28 = 28 gam.
Câu 10: Đốt cháy hoàn toàn 5,6 lít khí etilen ở đktc cần dùng lượng oxi (ở đktc) là
A. 11,2 lít.
B. 16,8 lít.
C. 22,4 lít.
D. 33,6 lít.
Đáp án: B
******************
Trên đây là nội dung bài học Hóa học 9 Bài 37: Etilen do THPT Ngô Thì Nhậm biên soạn bao gồm phần lý thuyết, giải bài tập và các câu hỏi trắc nghiệm có đáp án đầy đủ. Hy vọng các em sẽ nắm vững kiến thức về Etilen. Chúc các em học tập thật tốt và luôn đạt điểm cao trong các bài thi bài kiểm tra trên lớp.
Biên soạn bởi: Trường THPT Ngô Thì Nhậm
Chuyên mục: Hoá học 9