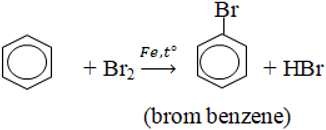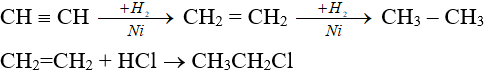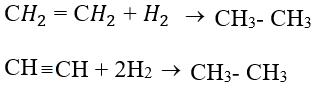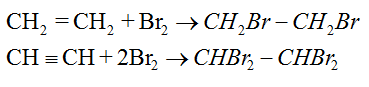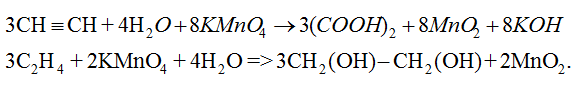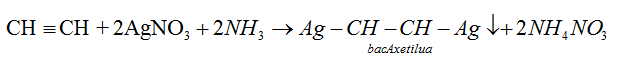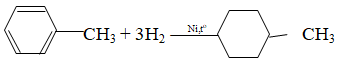Hóa học 11 Bài 38: Hệ thống hóa về hiđrocacbon – Giải bài tập SGK Hóa học 11 Bài 38
Hóa học 11 Bài 38: Hệ thống hóa về hiđrocacbon được THPT Ngô Thì Nhậm biên soạn hy vọng sẽ là là tài liệu hữu ích giúp các em nắm vững kiến thức bài học và đạt kết quả tốt trong các bài thi, bài kiểm tra trên lớp.
Tóm tắt lý thuyết Hóa học 11 Bài 38
I. Hidrocacbon thơm
1. Đặc điểm cấu trúc và khả năng phản ứng
– Có vòng benzen. 6 nguyên tử Csp2 liên kết tạo thành lục giác đều.
– Các aren dễ thế, khó cộng, bền với chất oxi hóa.
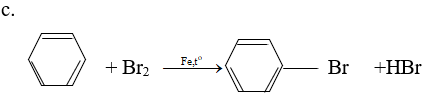
2. Phản ứng thế
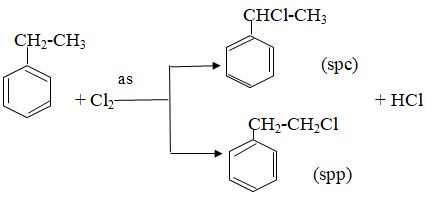
– Halogen thế vào nhân khi có Fe xúc tác:
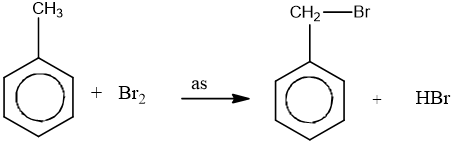
– Thế vào nhánh trong điều kiện chiếu sáng:
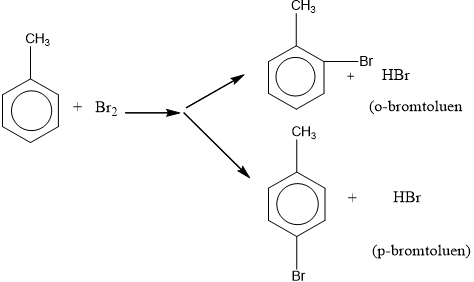
– Khi có sẵn nhóm thế ở nhân benzen, sản phẩm thế được định hưởng theo quy tắc sau:
+ Nếu vòng benzen đã có sẵn nhóm thế loại I (-OH, ankyl, -NH2, …) thì phản ứng thế xảy ra dễ hơn so với benzen và ưu tiên thế vào vị trí o- và p-.
+ Nếu vòng benzen đã có sẵn nhóm thế loại II (-COOH, -CHO, -CH=CH2) thì phản ứng thế xảy ra khó hơn so với benzen và ưu tiên thế vào vị trí m-.
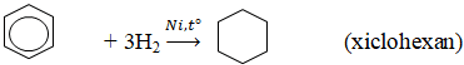
3. Phản ứng cộng
Đun nóng có xúc tác kim loại, aren cộng H2 tạo thành xicloankan.
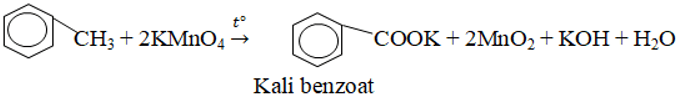
4. Phản ứng oxi hóa
– Cháy tỏa nhiều nhiệt.
– Vòng benzen không bị oxi hóa, nhánh ankykl bị oxi hóa thành nhóm –COOH.
Ví dụ:
II. Hidrocacbon no
1. Đặc điểm cấu trúc và khả năng phản ứng
– Chỉ có các nguyên tử Csp3.
– Tương đối trơ ở điều kiện thường.
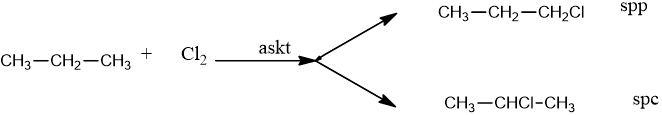
2. Phản ứng thế
– Khi đun nóng hoặc chiếu sáng: Clo có thể thế ở nhiều vị trí khác nhau còn brom thế ở C bậc cao.
3. Phản ứng cộng
Không có phản ứng cộng (trừ xiclopropan và xiclobutan).
4. Phản ứng oxi hóa
– Cháy, tỏa nhiệt.
– Chỉ bị oxi hóa ở nhiệt độ cao hoặc có thêm xúc tác.
CnH2n+2 + O2 → nCO2 + (n + 1)H2O
III. Hidrocacbon không no
1. Đặc điểm cấu trúc và khả năng phản ứng
– Có C lai hóa sp2 hoặc sp.
– Trung tâm các phản ứng hóa học do các liên kết π kém bền.
– Phản ứng đặc trưng là phản ứng cộng.
2. Phản ứng thế
– Ở nhiệt độ cao, clo thế H ở C bên cạnh Csp2.
– Phản ứng thế của ank-1-in:
CH≡CH + AgNO3 + NH3 → CAg≡CAg↓ (Bạc Axetilen) + 2NH4NO3
3. Phản ứng cộng
– Anken, ankin dễ cộng với H2, HX (X: OH–, halogen).
4. Phản ứng oxi hóa
– Cháy, tỏa nhiệt.
– Dễ bị oxi hóa bởi dd KMnO4 và các chất oxi hóa khác.
Ví dụ:
3CH2=CH2 + 4H2O + 2KMnO4 → 3HO–CH2–CH2–OH + 2MnO2↓ + 2KOH
Giải bài tập SGK Hóa học 11 Bài 38
Bài 1 (trang 172 SGK Hóa 11)
So sánh tính chất hoá học của:
a. Anken với ankin
b. Ankan với ankylbenzen
Cho ví dụ minh hoạ
Lời giải:
∗ So sánh tính chất hóa học anken và ankin:
– Giống nhau :
+ Cộng hiđro.
+ Cộng brom (dung dịch).
+ Cộng HX theo quy tắc Mac-côp-nhi-côp.
+ Làm mất màu dung dịch KMnO4.
– Khác nhau :
+ Anken : Không có phản ứng thế bằng ion kim loại.
+ Ankin : Ank-1-in có phản ứng thế bằng ion kim loại.
∗ So sánh tính chất hóa học ankan và ankybenzen:
– Giống nhau:
+ Phản ứng thế (halogen):
CH4 + Cl2 → CH3Cl + HCl
+ Phản ứng oxi hóa:
CH4 + 2O2 → CO2 +2H2O
C7H8 + 😯2 → 7CO2 + 4H2O
– Khác nhau:
+ Ankan: có phản ứng tách
C2H6 –500oC, xt→ CH2 = CH2 + H2
+ Ankylbenzen: có phản ứng cộng
Bài 2 (trang 172 SGK Hóa 11)
Trình bày phương pháp hoá học
a. Phân biệt các bình đựng khí riêng biệt không dán nhãn: H2, O2, CH4, C2H4, C2H2
b. Tách riêng khí metan từ hỗn hợp với lượng nhỏ các chất C2H4, C2H2.
Lời giải:
a. Lấy các mẫu khí nhỏ từ các bình đừng khí và đánh số theo thứ tự.
– Cho tàn đóm qua các mẫu khí, mẫu nào làm tàn đóm bùng cháy thì đó là O2.
– Lần lượt dẫn các mẫu khí còn lại qua dung dịch AgNO3/NH3, mẫu khí nào làm dung dịch xuất hiện kết tủa vàng thì đó là C2H2.
CH≡CH + 2AgNO3 + 2NH3 → AgC≡CAg↓ + 2NH4NO3
– Lần lượt dẫn các mẫu khí còn lại qua dung dịch brôm, khí nào làm nhạt màu dung dịch brôm thì đó là C2H4.
CH2=CH2 + Br2 (nâu đỏ) → BrCH2-CH2Br (không màu)
– Đốt cháy hai mẫu khí còn lại, dẫn sản phẩm qua bình đựng dung dịch Ca(OH)2 dư, nếu xuất hiện kết tủa trắng thì đó là CH4
2H2 + O2 → 2H2O
CH4 + 2O2 → CO2 + 2H2O
CO2 + Ca(OH)2 → CaCO3↓ + H2O
– Khí còn lại là H2
b. Cho hỗn hợp khí đi qua dung dịch Br2 dư, C2H4 và C2H2 sẽ tác dụng hết với dung dịch Br2, khí đi ra là metan.
CH2=CH2 + Br2 (nâu đỏ) → BrCH2-CH2Br (không màu)
CH≡CH + 2Br2 (nâu đỏ) → Br2CH-CHBr2 (không màu)
Bài 3 (trang 172 SGK Hóa 11)
Viết các phương trình hoá học của các phản ứng hoàn thành dãy chuyển hoá sau:
Lời giải:
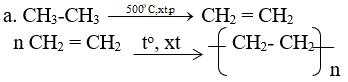
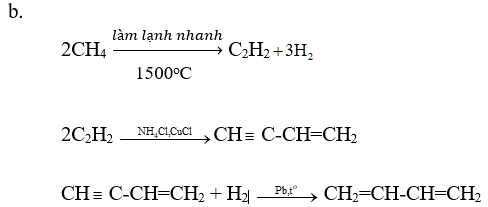
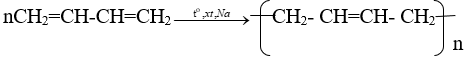
Bài 4 (trang 172 SGK Hóa 11)
Viết phương trình hoá học tổng quát của phản ứng đốt cháy các loại hiđrocacbon đã nêu trong bảng 7.2. Nhận xét về tỉ lệ số mol CO2 và số mol H2O trong sản phẩm cháy của mỗi loại hiđrocacbon.
Lời giải:
Bài 5 (trang 172 SGK Hóa 11)
Khi đốt cháy hoàn toàn hiđrocacbon X (là chất lỏng ở điều kiện thường) thu được CO2 và H2O có số mol theo tỉ lệ 2:1. Công thức phân tử của X có thể là công thức nào sau đây?
A. C4H4
B. C5H12
C. C6H6
D. C2H2
Lời giải:
– Đáp án C
– Khi đốt cháy X thu được CO2 và H2O có số mol theo tỉ lệ 2 : 1
⇒ X có số C bằng số H
Mà X là chất lỏng ở điều kiện thường nên X chỉ có thể là C6H6
Trắc nghiệm Hóa học 11 Bài 38 có đáp án
Bài 1: Cho các chất sau : metan, etilen, but-2-in và axetilen. Kết luận đúng là
A. cả 4 chất đều có khả năng làm mất màu dung dịch brom.
B. có hai chất tạo kết tủa với dung dịch bạc nitrat trong dung dịch amoniac
C. có 3 chất có khả năng làm mất màu dung dịch brom.
D. không có chất nào làm nhạt màu dung dịch kali pemanganat.
Lời giải
Đáp án: C
Bài 2: Hiđro hóa hoàn toàn hiđrocacbon mạch hở X thu được isopentan. Số công thức cấu tạo có thể có của X là
A.4
B. 5
C. 6
D. 7
Lời giải
Đáp án: D
CH3 – CH(CH3) – CH = CH2; CH3 – C(CH3) = CH – CH3; CH2 = C(CH3) – CH2 – CH3
CH3 – C(CH3) = C = CH2; CH2 = C(CH3) – CH= CH2; CH3 – CH(CH3) – C≡CH;
CH2 = C(CH3) – C≡CH
Bài 3: Dẫn 4,48 lít (đktc) hỗn hợp X gồm hai anken kế tiếp trong dãy đồng đẳng vào lượng dư dung dịch Br2, thấy dung dịch Br2 nhạt màu đồng thời khối lượng bình đựng tăng 7,0 gam. Công thức của 2 anken là
A. C2H4và C3H6.
B. C3H6và C4H8.
C. C4H8và C5H10.
D. C5H10 và C6H12.
Lời giải
Đáp án: A
Gọi CTTB của X là: CnH2n
nX = 0,2
m bình brom tăng 7g ⇒ mX = 7
⇒ 14n = 7:0,2 = 35 ⇒ n = 2,5
⇒ C2H4 và C3H6
Bài 4: Ba hiđrocacbon X,Y, Z là đồng dẳng kế tiếp, khối lượng phân tử của Z bằng 2 lần khối lượng phân tử của X. Các chất X, Y , Z thuộc dãy đồng đẳng
A.ankan
B. ankadien
C. anken
D. ankin
Lời giải
Đáp án: C
Phân tử Z hơn phân tử X 2 nhóm CH2 ⇒ MZ = MX + 28
⇒ MZ = 2MX ⇒ 2MX = MX + 28 ⇒ MX = 28 ⇒ X là C2H4 (anken)
Bài 5: Hỗn hợp khí X gồm etilen, metan, propin và viyl axetilen có tỉ khối so với H2 là 17. Đốt cháy hoàn toàn 0,05 ml hỗn hợp X rồi hấp thụ toàn bộ sản phẩm cháy vào bình đựng dung dịch Ca(OH)2 (dư) thì khối lượng bình tăng thêm m gam. Giá trị của m là
A.5,85
B. 3,39
C. 6,60
D. 7,30
Lời giải
Đáp án: D
Đặt CTPT X: CxH4; MX = 17.2 = 34 ⇒ 12x + 4 = 34 ⇒ x = 2,5
nCO2 = 0,05.2,5 = 0,125 (mol); nH2O = 0,05 . 2 = 0,1 mol
⇒ m = 0,125.44 + 0,1.18 = 7,3 (gam)
Bài 6: Đốt cháy hoàn toàn 20,0 ml hỗn hợp X gồm C3H6, CH4, CO (thể tích CO gấp hai lần thể tích CH4), thu được 24,0 ml CO2 (các thể tích khí đo cùng ở điều kiện nhiệt độ và áp suất). Tỉ khối của X so với khí hiđro là
A. 22,2
B. 25,8
C. 12,9
D. 11,1
Lời giải
Đáp án: C
Gọi số mol CH4 là x mol ⇒ nCO = 2x; nC3H6 = 20 – 3x
Bảo toàn C:
nCO2 = 3.(20 – 3x) + 2x + x = 24 ⇒ x = 6 mol
⇒ mX = mCO + mCH4 + mC3H6 = 12. 28 + 6.16 + 2.42 = 516
⇒ MX = 516 : 20 = 25,8 ⇒ dX/H2 = 12,9
Bài 7: Đốt cháy 6,72 lít (đktc) hỗn hợp gồm hai hiđrocacbon X và Y (MY > MX) thu được 11,2 lít CO2 (đktc) vào 10,8 gam H2O. Công thức của X là
A.C2H6
B. C2H4
C. CH4
D. C2H2
Lời giải
Đáp án: C
Gọi số C trong X và Y: n và m (n < m)
Số mol X và Y lần lượt là: x và y
x + y = 0,3 mol;
CO2 = nx + ny = 0,5 ⇒ n(x + y) < 0,5
⇒ n < 1,6 ⇒ X là CH4
Bài 8: Đốt cháy hoàn toàn hỗn hợp M gồm một ankan X và một ankin Y, thu được số mol CO2 bằng số mol H2O. thành phần phần trăm về số mol của X và Y trong hỗn hợp m lần lượt là
A. 75% và 25%
B. 20% vao 80%
C. 35% và 65%
D. 50% và 50%
Lời giải
Đáp án: D
nH2O- nCO2 = nX – nY; ⇒ nX = nY ⇒ %nX = %nY =50%
Bài 9: Hỗn hợp X gồm C2H2 và H2 có cùng số mol. Lấy một lượng hỗn hợp X cho qua chất xúc tác nung nóng, thu được hỗn hợp Y gồm C2H4, C2H6, C2H2 và H2. Sục Y vào dung dịch brom (dư) thì khối lượng bình brom tăng 10,8 gam và thoát ra 4,48 lít hỗn hợp khí (đktc) có tỉ khối so với H2 là 8. Thể tích O2(đktc) cần để đốt cháy hoàn toàn hỗn hợp Y là
A.22,4 lít
B. 44,8 lít
C. 26,88 lít
D. 33,6 lít
Lời giải
Đáp án: D
Khí thoát ra khỏi bình Br2 là Z: C2H6 và H2; VZ = 0,2
MZ = 16 ⇒ nC2H6 = nH2 = 0,1 mol ⇒ mZ = 0,1.30 + 0,1.2 = 3,2g
mbình brom tăng = mC2H4 + mC2H2 = 10,8g
mX = mY = mC2H4 + mC2H2 + mZ = 14g
C2H2 = nH2 = x mol ⇒ 26x + 2x = 14 ⇒ x = 0,5 mol
Đốt cháy Y cũng chính là đốt cháy x do vậy lượng oxi dùng là như nhau.
C2H2 (0,5) + 5/2O2 (1,25 mol) → 2CO2 + H2O
H2 (0,5) + 1/2O2 (0,25 mol) → H2O
⇒ nO2 = 1,5 mol ⇒ V = 33,6lít
Bài 10: Hỗn hợp khí X gồm 0,1 mol C2H2 ; 0,2 mol C2H4 và 0,3 mol H2. Đun nóng X với xúc tác Ni, sau một thời gian thu được hỗn hợp khí Y có tỉ khối so với H2 bằng 11. Hỗn hợp Y phản ứng tối đa với a mol Br2 trong dung dịch. Giá trị của a là
A.0,1
B. 0,2
C. 0,4
D. 0,3
Lời giải
Đáp án: B
BTKL: ⇒ mY = MX = 0,1.26. + 0,2.28 + 0,3.2 = 8,8 (gam)
⇒ mY = 11.2 = 22 ⇒ nY = 0,4 mol
Số mol H2 tham gia phản ứng là: nX – nY = (0,1 + 0,2 + 0,3) – 0,4 = 0,2 mol
nH2 (p/ư) + nBr2 = 2nC2H2 + nC2H4 ⇒ nBr2 = 2.0,1 +0,2 – 0,2 = 0,2 mol
Bài 11: Phân biệt metan và etilen dùng dung dịch nào sau đây ?
A.Br2
B. NaOH
C. NaCl
D. AgNO3 trong NH3
Lời giải
Đáp án: A
Bài 12: Để tách etilen ra khỏi hỗn hợp gồm etilen và axetilen ta dẫn hỗn hợp qua dung dịch
A. Br2
B. KMnO4
C. HCl
D. AgNO3 trong NH3
Lời giải
Đáp án: D
Bài 13: Cho các chất : etilen, axetilen, vinyl axetilen, but- I-in, but-2-in. Trong các chất trên,số chất phản ứng được với dung dịch AgNO3 tạo kết tủa là
A.3
B. 4
C. 5
D. 2
Lời giải
Đáp án: A
Bài 14: Chất nào sau đây làm mất màu dung dịch KMnO4 ở điều kiện thường ?
A.benzen
B. metan
C. toluen
D. axetilen
Lời giải
Đáp án: D
Bài 15: Chất nào dưới đây khi phản ứng với HCl thu được sản phẩm chính là 2-clobutan ?
A.but-2-in
B. buta-1,3-điện
C. but-1-in
D. but-1-en
Lời giải
Đáp án: D
Bài 16: Công thức đơn giản nhất của một hi đrocacbon là CnH2n-1. Hiđrocacbon đó thuộc dãy đồng đẳng của
A.ankan
B. ankin
C. anken
D. ankadien
Lời giải
Đáp án: A
******************
Trên đây là nội dung bài học Hóa học 11 Bài 38: Hệ thống hóa về hiđrocacbon do THPT Ngô Thì Nhậm biên soạn bao gồm phần lý thuyết, giải bài tập và các câu hỏi trắc nghiệm có đáp án đầy đủ. Hy vọng các em sẽ nắm vững kiến thức về Hệ thống hóa về hiđrocacbon. Chúc các em học tập thật tốt và luôn đạt điểm cao trong các bài thi bài kiểm tra trên lớp.
Biên soạn bởi: Trường THPT Ngô Thì Nhậm
Chuyên mục: Hoá học 11