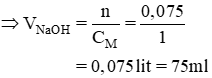Hóa học 11 Bài 11: Axit photphoric và muối photphat – Giải bài tập SGK Hóa học 11 Bài 11
Hóa học 11 Bài 11: Axit photphoric và muối photphat được THPT Ngô Thì Nhậm biên soạn hy vọng sẽ là là tài liệu hữu ích giúp các em nắm vững kiến thức bài học và đạt kết quả tốt trong các bài thi, bài kiểm tra trên lớp.
Tóm tắt lý thuyết Hóa học 11 Bài 11
Axit Photphoric H3PO4
I. Cấu tạo phân tử
Công thức cấu tạo:
II. Tính chất vật lí
Là chất rắn dạng tinh thể trong suốt, không màu, nóng chảy ở 42,5ºC. Dễ chảy rữa và tan vô hạn trong nước.
III. Tính chất hóa học
Bạn đang xem: Hóa học 11 Bài 11: Axit photphoric và muối photphat – Giải bài tập SGK Hóa học 11 Bài 11
a. Tính oxi hóa – khử
Axít photphoric khó bị khử (do P ở mức oxi hóa +5 bền hơn so với N trong axit nitric), không có tính oxi hóa.
b. Tính axit: Axít photphoric là axit có 3 lần axit, có độ mạnh trung bình. Trong dung dịch nó phân li ra 3 nấc:
H3PO4 ⇋ H+ + H2PO4– ⇒ k1 = 7, 6.10-3
H2PO4– ⇋ H+ + HPO42- ⇒ k2 = 6,2.10-8
HPO42- ⇋ H+ + PO43- ⇒ k3 = 4,4.10-13
⇒ nấc 1 > nấc 2 > nấc 3.
⇒ Dung dịch axít photphoric có những tính chất chung của axit như làm quì tím hóa đỏ, tác dụng với oxit bazơ, bazơ, muối, kim loại.
⇒ Khi tác dụng với oxit bazơ, bazơ tùy theo lượng chất tác dụng mà axít photphoric tạo ra muối trung hòa, muối axit hoặc hỗn hợp muối:
H3PO4 + NaOH → NaH2PO4 + H2O
H3PO4 + 2NaOH → Na2HPO4 + 2H2O
H3PO4 + 3NaOH → Na3PO4 + 3H2O
IV. Ứng dụng và điều chế
1. Ứng dụng
Một lượng lớn axit photphoric dùng để điều chế các muối photphat và sản xuất phân lân.
2. Điều chế
a. Trong phòng thí nghiệm
P + 5HNO3 → H3PO4 + H2O + 5NO2
b. Trong công nghiệp
+ Cho H2SO4 đặc tác dụng với quặng photphorit hoặc quặng apatit:
Ca3(PO4)2 + 3H2SO4 → 3CaSO4 + 2H3PO4
Điều chế bằng phương pháp này không tinh khiết và lượng chất thấp.
+ Để điều chế H3PO4 có độ tinh khiết và nồng độ cao hơn người ta đốt cháy P để được P2O5 rồi cho P2O5 tác dụng với nước:
4P + 5O2 → 2P2O5
P2O5 + 3H2O → 2H3PO4
Muối Photphat
Axít photphoric tạo ra 3 loại muối:
– Muối photphat trung hòa: Na3PO4, Ca3(PO4)2, …
– Muối đihidrophotphat: NaH2PO4, Ca(H2PO4)2, …
– Muối hidrophotphat: Na2HPO4, CaHPO4, …
1. Tính tan
Tất cả các muối đihidrophotphat đều tan trong nước. Các muối hidrophotphat và photphat trung hòa đều không tan hoặc ít tan trong nước (trừ muối natri, kali, amoni).
2. Phản ứng thủy phân
Các muối photphat tan bị thủy phân trong dung dịch.
Na3PO4 + H2O ⇋ Na2HPO4 + NaOH
⇒ Dung dịch Na3PO4 có môi trường kiềm làm quỳ hóa xanh.
3. Nhận biết ion photphat
Thuốc thử là bạc nitrat.
3Ag+ + PO43- → Ag3PO4↓ (màu vàng)
Giải bài tập SGK Hóa học 11 Bài 11
Bài 1 (trang 53 SGK Hóa 11)
Viết phương trình hoá học dạng phân tử và dạng ion rút gọn của phản ứng giữa axit photphoric với lượng dư của:
a. BaO ;
b. Ca(OH)2 ;
c. K2CO3
Lời giải:
Các chất lấy dư nên muối tạo ra là muối trung hoà:
a. 2H3PO4 + 3BaO → Ba3(PO4)2 + 3H2O
Phương trình phân tử trùng với phương trình ion thu gọn
b. 2H3PO4 + 3Ca(OH)2 → Ca3(PO4)2 + 6H2O
2H3PO4 + 3Ca2+ + 6OH– → Ca3(PO4)2 + 6H2O
c. 2H3PO4 + 3K2CO3 → 2K3PO4 + 3H2O + 3CO2↑
2H3PO4 + 3CO32- → 2PO43- + 3H2O + CO2↑
Bài 2 (trang 53 SGK Hóa 11)
Nêu những điểm giống nhau và khác nhau về tính chất hoá học giữa axit nitric và axit photphoric. Dẫn ra những phản ứng hoá học để minh hoạ?
Lời giải:
– Những tính chất chung: Đều có tính axit
+ Chuyển màu chất chỉ thị: Quỳ tím chuyển thành màu hồng
+ Tác dụng với bazơ, oxit bazơ không có tính khử (các nguyên tố có số oxi hoá cao nhất):
3NaOH + H3PO4 → Na3PO4 + 3H2O
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
+ Tác dụng với một số muối của axit yếu và không có tính khử:
2HNO3 + CaCO3 → Ca(NO3)2 + H2O + CO2↑
2H3PO4 + 3Na2SO3 → 2Na3PO4 + 3H2O + 3SO2↑
– Những tính chất khác nhau:
| HNO3 | H3PO4 |
| – Axit HNO3 là axit mạnh
HNO3 → H+ + NO3– – Axit HNO3 có tính oxi hoá mạnh Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O S + 2HNO3 → H2SO4 + 2NO 3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O |
– Axit H3PO4 là một triaxit trung bình
H3PO4 ⇆ H+ + H2PO4– H2PO4– ⇆ H+ + HPO42- HPO42- ⇆ H+ + PO43- – Axit H3PO4 không có tính oxi hoá. 3Fe + 2H3PO4 → Fe3(PO4)2 + 3H2 S + H3PO4 → không phản ứng 3FeO +2H3PO4 → Fe3(PO4)2 + 3H2O |
Bài 3 (trang 54 SGK Hóa 11)
Phương trình điện li tổng cộng của H3PO4 trong dung dịch là:
H3PO4 ⇆ 3H+ + PO43-
Khi thêm HCl vào dung dịch:
A. Cân bằng trên chuyển dịch theo chiều thuận.
B. Cân bằng trên chuyển dịch theo chiều nghịch.
C. Cân bằng trên không bị dịch chuyển.
D. Nồng độ PO43- tăng lên.
Lời giải:
– Đáp án B.
– Khi thêm HCl vào làm tăng nồng độ H+ trong dung dịch. Theo nguyên lí chuyển dịch cân bằng, cân bằng chuyển dịch theo chiều làm giảm nồng độ H+
⇒ cân bằng chuyển dịch theo chiều nghịch.
Bài 4 (trang 54 SGK Hóa 11)
a) Lập các phương trình hóa học sau đây:
a. H3PO4 + K2HPO4 →
1 mol 1mol
b. H3PO4 + NaOH →
1 mol 1mol
c. H3PO4 + Ca(OH)2 →
2mol 1mol
d. H3PO4 + Ca(OH)2 →
2mol 3mol
Lời giải:
a. H3PO4 + K2HPO4 → 2KH2PO4
1 mol 1mol
b. H3PO4 + Ca(OH)2 → CaHPO4 + 2H2O
1 mol 1mol
c. 2H3PO4 + Ca(OH)2 → Ca(H2PO4)2 + 2H2O
2mol 1mol
d. 2H3PO4 + 3Ca(OH)2 → Ca3(PO4)2 + 6H2O
2mol 3mol
Bài 5 (trang 54 SGK Hóa 11)
Để thu được muối photphat trung hoà, cần lấy bao nhiêu ml dung dịch NaOH 1,00M cho tác dụng với 50,0ml H3PO4 0,50M?
Lời giải:
Ta có: nH3PO4 = 0,05.0,5 = 0,025(mol)
Phương trình phản ứng:
H3PO4 + 3NaOH → Na3PO4 + 3H2O
Từ ptpư suy ra:
nNaOH = 3nH3PO4 = 3. 0,025 = 0,075 (mol)
Trắc nghiệm Hóa học 11 Bài 11 có đáp án
Bài 1: Cho các chất sau : NaOH, H3PO4, NaH2PO4, Na2HPO4, Na3PO4. Trộn các chất trên với nhau theo từng đôi, số cặp xảy ra phản ứng là
A. 4.
B. 4.
C. 7.
D. 6.
Lời giải
Đáp án: D
Bài 2: Cho sơ đồ sau : HCl + muối X → H3PO4 + NaCl
Hãy cho biết có bao nhiêu muối X thỏa mãn.
A. 2.
B. 1.
C. 4.
D. 3.
Lời giải
Đáp án: D
Bài 3: Cho các phản ứng sau :
(1) Ca3(PO4)2 + C + SiO2 (lò điện);
(2) NH3 + O2 (to cao)
(3) Cu(NO3)2 (to cao)
(4) NH4Cl + NaOH.
Trong các phản ứng trên, những phản ứng tạo ra đơn chất là.
A.(1),(2),(4).
B. (1),(3),(4).
C. (2),(3),(4).
D. (1),(2),(3).
Lời giải
Đáp án: D
Bài 4: Cho dung dịch chưa a mol H2SO4 và dung dịch chứa 2,5a mol Na3PO4 thu được dung dịch X. các chất tan có trong dung dịch X là
A. Na3PO4, Na2HPO4và Na2SO4
B. H3PO4, H2SO4 và Na2SO4
C. Na2HPO4, H3PO4và Na2SO4
D. Na2HPO4 Na2HPO4 và Na2SO4
Lời giải
Đáp án: A
Bài 5: cho sơ đò chuyển hóa : P2O5 → X → Y → Z.
Các chất X, Y, Z lần lượt là
A. KH2PO4, K2HPO4, K3PO4
B. KH2PO4, K3PO4, K2HPO4
C. K3PO4, KH2PO4, K2HPO4,
D. K3PO4, K2HPO4, KH2PO4
Lời giải
Đáp án: C
Bài 6: Hòa tan hoàn toàn 3,1 gam P trong 100 gam dung dịch HNO3 63% (đặc nóng) thu được dung dịch X và V lít (đktc) khí NO2 duy nhất. Giá trị của V là
A. 11,2.
B. 5,6.
C. 10,08.
D. 8,96.
Lời giải
Đáp án: A
P (0,1) + 5HNO3 (0,5 mol) → H3PO4 + 5NO2 + H2O
⇒ HNO3 dư; nNO2 = 5nP = 0,5 mol
⇒ V = 11,2 lít
Bài 7: Thủy phân hoàn toàn 5,42 gam PX3 trong nước thu được dung dịch A. Trung hòa dung dịch A cần dùng 100 ml dung dịch NaOH 1M. Biết rằng H3PO3 là một axit 2 nấc. Công thức của PX3 là
A. PBr3.
B. PI3.
C. PF3.
D. PCl3.
Lời giải
Đáp án: A
PX3 (x) + 3H2O → H3PO3 (x) + 3HX (3x mol)
2NaOH + H3PO3 → Na2HPO3 + 2H2O
NaOH + HX → NaX + H2O
nNaOH = 2nH3PO3 + nHX = 5x = 0,1 ⇒ x = 0,02 mol
PX3 = 5,42 : 0,02 = 271 ⇒ X = 80 ⇒ Br ⇒ PBr3
Bài 8: Lấy 124 gam P đem điều chế H3PO4với hiệu suất phản ứng đạt 100%. Thể tích dung dịch H3PO4 35% (D = 1,25 gam/ml) có thể thu được là
A. 1220ml.
B. 936ml.
C. 1000ml.
D. 896ml.
Lời giải
Đáp án: D
Bảo toàn P: nH3PO4 = nP = 4 mol;
Bài 9: Lấy V ml dung dịch H3PO4 1M đem trộn với 100 ml dung dịch KOH 2M thu được dung dịch X có chứa 14,95 gam hỗn hợp muối.
a) Giá trị của V là
A. 85.
B. 75.
C. 125.
D. 150.
b) Các muối trong dung dịch X là
A. K2HPO4và KH2PO4
B. KH2PO4 và K3PO4
C. K3PO4, K2HPO4và KH2PO4
D. K3PO4 và K2HPO4.
Lời giải
Đáp án:
a/ B;
b/ D
Ta có: nH2O = nOH– = 0,2 mol
Áp dụng định luật bảo toàn khối lượng: mH3PO4 + mKOH = mMuối + mH2O
⇒ mH3PO4 = 14,95 + 0,2.18 – 0,2.56 = 7,35 gam ⇒ V = 7,35/98 : 1 = 0,075 = 75ml
Ta có: nOH– : nH3PO4 = 2,6 ⇒ Tạo 2 muối K3PO4 và K2HPO4
Bài 10: Cho dãy biến hóa sau :
Ca3(PO4)2 –+H2SO4→ H3PO4 –+Ca3PO4→ Ca(H2PO4)2
Biết hiệu suất 70% khối lượng dung dịch H2SO4 70% đã dùng đẻ điều chế được 467 gam Ca(H2PO4)2 theo sơ đồ biến hóa trên là
A. 800 gam.
B. 350 gam.
C. 400 gam.
D. 700 gam.
Lời giải
Đáp án: C
Ca3(PO4)2 + 3H2SO4 → 2H3PO4 + 3CaSO4
Ca3(PO4)2 + 4H3PO4 → 3Ca(H2PO4)2
nH2SO4 = 2nCa(H2PO4)2 = (467/234) : 70% = 2,85 mol (H = 70%)
mdd = 2,85. 98 : 70% = 400 gam
Bài 11: Phản ứng nào sau đây được sử dụng để điều chế H3PO4 trong phòng thí nghiệm ?
A. P + HNO3đặc, nóng
B. Ca3(PO4)2+ H2SO4 đặc
C. P2O5+ H2O
D. HPO3+ H2O
Lời giải
Đáp án: A
Bài 12: Khi đun nóng từ từ H3PO4 bị mất nước theo sơ đồ :
H3PO4 → X → Y → Z.
Các chất X, Y, Z lần lượt là
A. H2PO4, HPO3, H4P2O7
B. HPO3, H4P2O7, P2O5
C. H4P2O7, P2O5, HPO3
D. H4P2O7,HPO3, P2O5.
Lời giải
Đáp án: D
Bài 13: Thành phần chính của quặng photphorit là
A. CaPHO4
B. NH4H2PO4.
C. Ca(H2PO4)2.
D. Ca3(PO4)2.
Lời giải
Đáp án: D
Bài 14: Cho 4 dung dịch sau : Na3PO4, Na2HPO4, NaH2PO4 và H3PO4 có cùng nồng độ mol, có các giá trị pH lần lượt là : pH1, pH2, pH3 và pH4. Sự sắp xếp nào sau đây đúng với sự tăng dần ph ?
A. pH1< pH2< pH3 < pH4
B. pH4 < pH3 < pH2 < pH1
C. pH3< pH4< pH1 < pH2
D. pH2 < pH1 < pH4 < pH3
Lời giải
Đáp án: B
Bài 15: Nhận xét nào sau đây đúng ?
A. Thành phần chính của quặng apatit là 3Ca3(PO4)2, CaF2.
B. Trong công nghiệp photpho được điều chế từ Ca3P2, SiO2và C.
C. Ở điều kiện thường photpho đỏ tác dụng với O2tạo ra sản phẩm P2O5.
D. Các muối Ca3(PO4)2và CaHPO4đều tan trong nước.
Lời giải
Đáp án: A
******************
Trên đây là nội dung bài học Hóa học 11 Bài 11: Axit photphoric và muối photphat do THPT Ngô Thì Nhậm biên soạn bao gồm phần lý thuyết, giải bài tập và các câu hỏi trắc nghiệm có đáp án đầy đủ. Hy vọng các em sẽ nắm vững kiến thức về Axit photphoric và muối photphat. Chúc các em học tập thật tốt và luôn đạt điểm cao trong các bài thi bài kiểm tra trên lớp.
Biên soạn bởi: Trường THPT Ngô Thì Nhậm
Chuyên mục: Hoá học 11