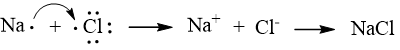Hóa học 10 Kết nối tri thức Bài 21: Nhóm halogen – Giải bài tập SGK Hóa học 10 Kết nối tri thức Bài 21
Hóa học 10 Kết nối tri thức Bài 21: Nhóm halogen được THPT Ngô Thì Nhậm biên soạn hy vọng sẽ là là tài liệu hữu ích giúp các em nắm vững kiến thức bài học và đạt kết quả tốt trong các bài thi, bài kiểm tra trên lớp.
Tóm tắt lý thuyết Hóa học 10 Kết nối tri thức Bài 21
I. Trạng thái tự nhiên
– Nhóm VIIA trong bảng tuần hoàn các nguyên tố hóa học còn gọi là nhóm halogen, gồm 6 nguyên tố: fluorine (F); chlorine (Cl); bromine (Br); iodine (I); astatine (At) và tennessine (Ts).
– Bốn nguyên tố F, Cl, Br, I tồn tại trong tự nhiên; còn At và Ts là các nguyên tố phóng xạ.
– Trong tự nhiên, halogen chỉ tồn tại ở dạng hợp chất, phần lớn ở dạng muối halide, phổ biến trong tự nhiên như calcium fluoride; sodium chloride.
– Trong cơ thể người, nguyên tố chlorine có trong máu và dịch vị dạ dày (ở dạng ion Cl–), nguyên tố iodine có ở tuyến giáp (ở dạng hợp chất hữu cơ).
II. Cấu tạo nguyên tử, phân tử
– Các nguyên tử halogen có 7 electron ở lớp ngoài cùng, dễ nhận thêm 1 electron để đạt được cấu hình electron bền vững của khí hiếm gần nhất:
ns2np5 + 1e → ns2np6
– Số oxi hóa đặc trưng của các halogen trong hợp chất là -1.
– Khi liên kết với các nguyên tố có độ âm điện lớn, các halogen có thể có số oxi hóa dương: +1; +3; +5; +7 (trừ fluorine có độ âm điện lớn nhất nên fluorine luôn có số oxi hóa bằng -1 trong mọi hợp chất).
– Ở trạng thái tự do, hai nguyên tử halogen góp chung một đôi electron để tạo phân tử có liên kết cộng hóa trị phân cực.
III. Tính chất vật lí
– Một số tính chất vật lí của halogen như: trạng thái tồn tại, màu sắc, nhiệt độ nóng chảy (tnc), nhiệt độ sôi (ts) của halogen được thể hiện ở bảng sau:
– Nhiệt độ nóng chảy, nhiệt độ sôi tăng từ F2 đến I2 do:
+ Tương tác van der Waals giữa các phân tử tăng.
+ Khối lượng phân tử tăng.
– Ở điều kiện thường, các halogen ít tan trong nước nhưng tan nhiều trong các dung môi hữu cơ như alcohol, benzene.
– Chú ý:
+ Trong y học, dung dịch iodine loãng trong ethanol được dùng làm thuốc sát trùng.
+ Bromine gây bỏng sâu khi tiếp xúc với da.
+ Hít thở không khí có chứa halogen với nồng độ vượt ngưỡng cho phép làm tổn thương niêm mạc đường hô hấp, gây co thắt phế quản, khó thở.
+ Ở nhiệt độ cao, iodine thăng hoa, chuyển tử thể rắn sang thể hơi dưới áp suất thường.
IV. Tính chất hóa học
Halogen là các phi kim điển hình, có tính oxi hóa mạnh, tính oxi hóa giảm dần từ fluorine đến iodine.
1. Tác dụng với kim loại
– Các halogen phản ứng trực tiếp với nhiều kim loại, tạo muối halide.
– Ví dụ:
+ Sodium nóng chảy sẽ cháy với ngọn lửa sáng chói trong khí chlorine, tạo thành sodium chloride:
2Na + Cl2 2NaCl
+ Dây sắt (iron) nung đỏ sẽ bốc cháy trong khí chlorine, tạo thành khói màu nâu đỏ là iron(III) chloride:
2Fe + 3Cl2 2FeCl3
2. Tác dụng với hydrogen
– Các halogen phản ứng với hydrogen, tạo thành hydrogen halide.
– Mức độ phản ứng của các halogen với hydrogen giảm dần khi đi từ fluorine đến iodine, phù hợp với tính oxi hóa của các halogen giảm dần từ F2 đến I2.
3. Tác dụng với nước
– Khi tan vào nước, một phần Cl2 tác dụng với nước tạo thành HCl (hydrochloric acid) và HClO (hypochlorous acid):
Cl2 + H2O ⇄ HCl + HClO
– Hypochlorous acid có tính oxi hóa mạnh nên chlorine trong nước có khả năng diệt khuẩn, tẩy màu và được ứng dụng trong khử trùng nước sinh hoạt.
– Chú ý:
+ F2 phản ứng mạnh với nước ngay nhiệt độ thường, giải phóng O2:
2F2 + 2H2O → 4HF + O2
+ Các halogen Cl2; Br2 và I2 phản ứng chậm với nước và mức độ phản ứng giảm dần từ Cl2 đến I2.
4. Tác dụng với dung dịch kiềm
– Chlorine phản ứng với dung dịch sodium hydroxide ở điều kiện thường, tạo thành nước Javel (Gia – ven):
Cl2 + 2NaOH → NaCl + NaClO + H2O
Nước Javel chứa NaClO (sodium hypochlorite); NaCl và một phần NaOH dư được dùng làm chất tẩy rửa, khử trùng.
– Khi đun nóng, Cl2 phản ứng với dung dịch postassium hydroxide tạo thành muối chlorate:
3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O
Potassium chlorate là chất oxi hóa mạnh, được sử dụng chế tạo thuốc nổ, hỗn hợp đầu que diêm,…
5. Tác dụng với dung dịch halide
– Chlorine có thể oxi hóa ion Br– trong dung dịch muối bromide và ion I– trong dung dịch muối iodine, bromine có thể oxi hóa I– trong dung dịch muối iodide.
– Ví dụ:
Cl2 + 2NaBr → 2NaCl + Br2
Br2 + 2NaI → 2NaBr + I2
– Trong công nghiệp, phản ứng giữa chlorine và ion bromide được ứng dụng để điều chế bromine từ nước biển.
V. Điều chế chlorine
– Năm 1774, C. W. Scheele, nhà hóa học người Thụy Điển, điều chế được chlorine khi cho quặng pyrolusite (MnO2) tác dụng với hydrochloric đặc:
MnO2 + 4HCl đặc MnCl2 + Cl2 + 2H2O
– Ngày nay, phản ứng trên vẫn được dùng khi cần điều chế Cl2 trong phòng thí nghiệm. Ngoài ra, còn có thể thay MnO2 bằng KMnO4 rắn để điều chế khí Cl2:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
– Trong công nghiệp, chlorine được sản xuất ở nhiệt độ thường bằng cách điện phân dung dịch muối ăn bão hòa, có màng ngăn giữa các điện cực:
2NaCl + 2H2O 2NaOH + H2 + Cl2
Giải bài tập SGK Hóa học 10 Kết nối tri thức Bài 21
Mở đầu trang 104 Hóa học 10
Trong tự nhiên, một số phi kim như carbon, nitrogen, oxygen tồn sao tại ở cả dạng đơn chất và hợp chất, còn các halogen đều chỉ tồn tại ở dạng hợp chất. Vì có sự khác biệt này?
Lời giải:
Trong tự nhiên, các halogen tồn tại ở dạng hợp chất vì các halogen có tính oxi hóa mạnh nên phản ứng với các chất trong tự nhiên tạo ra hợp chất.
Câu hỏi 1 trang 105 Hóa học 10
Kể tên một số hợp chất phổ biến của halogen trong tự nhiên.
Lời giải:
Một số hợp chất phổ biến của halogen trong tự nhiên như calcium fluoride, sodium chloride, …
Câu hỏi 2 trang 106 Hóa học 10
Trong tự nhiên, các nguyên tố halogen tồn tại ở dạng hợp chất. Viết công thức một vài hợp chất của halogen thường được dùng trong thực tế.
Lời giải:
Một vài hợp chất của halogen thường được dùng trong thực tế là sodium chloride (NaCl), calcium flouride (CaF2), sodium hypochlorite (HClO), potassium chlorate (KClO3), sodium iodide (NaI), …
Câu hỏi 3 trang 106 Hóa học 10
Nguyên tử halogen có thể nhận 1 electron từ nguyên tử kim loại hoặc góp chung electron với nguyên tử phi kim.
Mô tả sự hình thành liên kết trong phân tử NaCl và HCl để minh hoạ.
Lời giải:
Sự hình thành liên kết trong phân tử NaCl
Nguyên tử Na nhường 1 electron để tạo thành ion Na+ còn nguyên tử Cl nhận electron để trở thành ion Cl–. Các ion Na+ và Cl– sẽ hút nhau tạo thành liên kết ion.
Sự hình thành liên kết trong phân tử HCl
Nguyên tử hydrogen liên kết với nguyên tử chlorine bằng cách mỗi nguyên tử góp 1 electron tạo thành 1 cặp electron dùng chung trong phân tử HCl. Khi đó nguyên tử hydrogen có 2 electron (cấu hình electron bền vững của nguyên tử khí hiếm He) và nguyên tử chlorine có 8 electron lớp ngoài cùng, thoả mãn quy tắc octet.
Câu hỏi 4 trang 107 Hóa học 10
Từ Bảng 21.2, nhận xét xu hướng biến đổi nhiệt độ nóng chảy, nhiệt độ sôi của các halogen và giải thích.
Lời giải:
Nhiệt độ nóng chảy, nhiệt độ sôi tăng từ F2 đến I2 do:
– Tương tác van der Waals giữa các phân tử tăng.
– Khối lượng phân tử tăng.
Câu hỏi 5 trang 108 Hóa học 10
Xác định chất oxi hoá, chất khử trong phản ứng của sodium và iron với chlorine, dùng mũi tên chỉ rõ sự nhường electron từ chất khử sang chất oxi hoá.
Lời giải:
⇒ Na đóng vai trò là chất khử, còn Cl2 đóng vai trò là chất oxi hóa.
⇒ Fe đóng vai trò là chất khử, còn Cl2 đóng vai trò là chất oxi hóa.
Câu hỏi 6 trang 109 Hóa học 10
Một nhà máy nước sử dụng 5 mg Cl2 để khử trùng 1 L nước sinh hoạt. Tính khối lượng Cl2 nhà máy cần dùng để khử trùng 80 000 m3 nước sinh hoạt.
Lời giải:
Đổi 80 000m3 = 80 000 000 L = 8.107 L
5 mg Cl2 được dùng để khử trùng 1 L nước sinh hoạt.
x mg Cl2 được dùng để khử trùng 8.107 L nước sinh hoạt.
⇒ x = = 4.108 mg = 400 kg
Câu hỏi 7 trang 110 Hóa học 10
Khí Cl2 phản ứng với dung dịch sodium hydroxide nóng tạo thành sodium chloride, sodium chlorate và nước.
Lập phương trình hoá học của phản ứng trên theo phương pháp thăng bằng electron, chỉ rõ chất oxi hoá, chất khử.
Lời giải:
Phản ứng: Cl2 + NaOH NaCl + NaClO3 + H2O
⇒ Cl2 vừa đóng vai trò là chất khử vừa đóng vai trò là chất oxi hóa.
⇒ Phương trình: 3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O
Câu hỏi 8 trang 110 Hóa học 10
Viết phương trình hoá học minh hoạ tính oxi hoá giảm dần trong dãy Cl2, Br2, I2.
Lời giải:
Phương trình minh họa tính oxi hóa giảm dần trong dãy Cl2, Br2, I2 là:
Cl2 + 2NaBr → 2NaCl + Br2
Br2 + 2NaI → 2NaBr + I2
Câu hỏi 9 trang 111 Hóa học 10
Khi sản xuất chlorine trong công nghiệp, NaOH và H2 được tạo thành ở cực âm, còn Cl2 được tạo thành ở cực dương. Tại sao cần sử dụng màng ngăn xốp để ngăn cách hai điện cực?
Lời giải:
Nếu không sử dụng màng ngăn xốp để ngăn cách hai điện cực thì khí Cl2 ở cực dương sẽ phản ứng được với NaOH bên cực âm.
2NaOH + Cl2 → NaCl + NaClO + H2O
Trắc nghiệm Hóa 10 Kết nối tri thức Bài 21 (có đáp án)
Câu 1. Nhóm halogen gồm các nguyên tố thuộc nhóm nào?
A. VA;
B. VIA;
C. VIIA;
D. VIIIA
Lời giải
Đáp án đúng là: C
Nhóm halogen gồm các nguyên tố thuộc nhóm VIIA và gồm 6 nguyên tố: fluorine (F), chlorine (Cl), bromine (Br), iodine (I), astantine (At) và tennessine (Ts), trong đó F, Cl, Br, I tồn tại trong tự nhiên, còn At và Ts là các nguyên tố phóng xạ.
Câu 2. Trong tự nhiên, halogen tồn tại ở dạng nào?
A. Đơn chất;
B. Hợp chất;
C. Không tồn tại;
D. Cả đơn chất và hợp chất.
Lời giải
Đáp án đúng là: B
Trong tự nhiên, halogen chỉ tồn tại ở dạng hợp chất, phần lớn ở dạng muối halide.
Trong cơ thể người, nguyên tố chlorine có trong máu và dịch vị dạ dày (ở dạng ion Cl–), nguyên tố iodine có ở tuyến giáp (ở dạng hợp chất hữu cơ).
Câu 3. Số oxi hóa của chlorine trong các chất sau: KClO3; HCl; NaClO; HClO2 lần lượt là?
A. +5, +1, -1, +3;
B. +5, -1, +1, +3;
C. -5, +1, -1, +3;
D. +5, +1, -1, -3.
Lời giải
Đáp án đúng là: B
Số oxi hóa của chlorine trong các chất sau: KClO3; HCl; NaClO; HClO2 lần lượt là: +5, -1, +1, +3.
Câu 4. Chất chỉ có tính oxi hoá là:
A. Cl2;
B. F2;
C. Br2;
D. Cả 3 chất A, B, C.
Lời giải
Đáp án đúng là: B
Fluorine có độ âm điện lớn nhất nên fluorine luôn có số oxi hóa bằng -1 trong mọi hợp chất ⇒ F2 chỉ có tính oxi hóa.
Các halogen khác có thể có số oxi hóa dương: +1, +3, +5, +7.
Câu 5. Nhiệt độ nóng chảy từ F2, Cl2, Br2, I2 như thế nào?
A. Tăng dần;
B. Không theo quy luật;
C. Giảm dần ;
D. Không tăng, không giảm.
Lời giải
Đáp án đúng là: A
Nhiệt độ nóng chảy tăng từ F2 đến I2 do:
– Tương tác van der Waals giữa các phân tử tăng
– Khối lượng phân tử tăng.
Câu 6. Trong các tính chất sau, những tính chất nào chung cho các đơn chất halogen?
A. Vừa có tính oxi hóa, vừa có tính khử;
B. Phân tử gồm hai nguyên tử;
C. Ở nhiệt độ thường, đều ở trạng thái khí;
D. Tác dụng mạnh với nước.
Lời giải
Đáp án đúng là: B
A. Loại vì fluorine chỉ có tính oxi hóa.
C. Loại vì ở điều kiện thường, F2 và Cl2 ở trạng thái khí, Br2 ở trạng thái lỏng và I2 ở trạng thái rắn.
D. F2 phản ứng mãnh liệt với nước ngay tại nhiệt độ thường, Cl2, Br2 và I2 phản ứng chậm với nước và mức độ phản ứng giảm dần từ Cl2 đến I2.
Câu 7. Bromine bị lẫn tạp chất là chlorine. Để thu được bromine cần làm cách nào sau đây?
A. Dẫn hỗn hợp đi qua dung dịch NaOH loãng.
B. Dẫn hỗn hợp đi qua nước.
C. Dẫn hỗn hợp đi qua dung dịch NaBr.
D. Dẫn hỗn hợp đi qua dung dịch NaI.
Lời giải
Đáp án đúng là: C
Do chlorine có thể oxi hóa ion Br– trong dung dịch muối bromine nên có thể dùng dung dịch NaBr để loại bỏ chlorine, thu được bromine.
Cl2 + 2NaBr → 2NaCl + Br2
Câu 8. Trong 4 hỗn hợp sau đây, hỗn hợp nào là nước Javel?
A. HCl + HClO + H2O;
B. NaCl + NaClO + H2O;
C. HCl + NaClO + H2O;
D. NaCl + HClO + H2O.
Lời giải
Đáp án đúng là: B
Chlorine phản ứng với dung dịch kiềm ở điều kiện thường, tạo thành nước Javel:
Cl2 + 2NaOH → NaCl + NaClO + H2O
Câu 9. Trong phản ứng sau: Cl2 + H2O ⇌ HCl + HClO. Phát biểu nào sau đây đúng?
A. Chlorine chỉ đóng vai trò chất oxi hoá;
B. Chlorine chỉ đóng vai trò chất khử;
C. Chlorine vừa đóng vai trò chất oxi hoá, vừa đóng vai trò chất khử;
D. Nước đóng vai trò chất khử.
Lời giải
Đáp án đúng là: C
0Cl2+H2O⇄H−1Cl+H+1
Chlorine từ số oxi hóa 0 xuống -1 và lên +1 nên vừa đóng vai trò chất oxi hóa, vừa đóng vai trò chất khử.
Câu 10. Chlorine không phản ứng với chất nào sau đây?
A. Ca(OH)2;
B. NaBr;
C. NaCl;
D. NaOH.
Lời giải
Đáp án đúng là: C
Chlorine không phản ứng với NaCl
Cl2 + Ca(OH)2 → CaOCl2 + H2O
Cl2 + 2NaBr → 2NaCl + Br2
Cl2 + 2NaOH → NaCl + NaClO + H2O
Câu 11. Cho phản ứng: Fe + Cl2 →X. Công thức hoá học của X là:
A. chỉ có FeCl3;
B. chỉ có FeCl2;
C. chỉ có Fe2Cl3;
D. hỗn hợp FeCl2 và FeCl3.
Lời giải
Đáp án đúng là: A
Dây sắt nung đỏ sẽ bốc cháy trong khí chlorine, tạo thành khói màu nâu đỏ là iron(III) chloride.
2Fe+3Cl2→2FeCl3
Câu 12. Nguyên tắc chung để điều chế chlorine trong phòng thí nghiệm:
A. Điện phân nóng chảy các muối halide;
B. Dùng fluorine đẩy clo ra khỏi dung dịch muối;
C. Nhiệt phân các muối giàu chlorine;
D. Cho các chất oxi hoá mạnh (MnO2 hoặc KMnO4) tác dụng với HCl đặc.
Lời giải
Đáp án đúng là: D
Cho các chất oxi hoá mạnh (MnO2 hoặc KMnO4) tác dụng với HCl đặc là phương pháp điều chế Cl2 trong phòng thí nghiệm.
Câu 13. Phản ứng của H2 và F2 có thể xảy ra nổ mạnh ngay trong điều kiện tối thiểu nào?
A. Ở nhiệt độ phòng và trong bóng tối;
B. Ánh sáng hoặc to;
C. 200oC, xúc tác Pt;
D. 300oC, xúc tác Pt.
Lời giải
Đáp án đúng là: A
Phản ứng của H2 và F2 xảy ra ngay ở nhiệt độ phòng và trong bóng tối.
Phản ứng của H2 và Cl2 xảy ra khi có ánh sáng hoặc to.
Phản ứng của H2 và Br2 xảy ra ở 200oC, xúc tác Pt.
Phản ứng của H2 và I2 xảy ra 300oC, xúc tác Pt.
Câu 14. Sản phầm tạo thành khi đun nóng Cl2 trong dung dịch kiềm có chứa muối nào?
A. KClO;
B. KClO2;
C. KClO3;
D. KClO4.
Lời giải
Đáp án đúng là: B
Câu 15. Phát biểu nào sau đây đúng?
A. Ở điều kiện thường, các halogen tan nhiều trong nước và các dung môi hữu cơ;
B. Ở nhiệt độ cao, iodine thăng hoa, chuyển từ thể rắn sang thể hơi;
C. Phản ứng giữa H2 và I2 gây nổ mạnh;
D. Khí chlorine ẩm làm giấy màu chuyển sang màu đỏ.
Lời giải
Đáp án đúng là: B
A. Loại. Ở điều kiện thường, các halogen tan ít trong nước và tan nhiều trong các dung môi hữu cơ.
C. Loại. Phản ứng giữa H2 và I2 là phản ứng thuận nghịch.
D. Loại. Khí chlorine ẩm làm giấy màu bị mất màu.
******************
Trên đây là nội dung bài học Hóa học 10 Kết nối tri thức Bài 21: Nhóm halogen do THPT Ngô Thì Nhậm biên soạn bao gồm phần lý thuyết, giải bài tập và các câu hỏi trắc nghiệm có đáp án đầy đủ. Hy vọng các em sẽ nắm vững kiến thức về Nhóm halogen. Chúc các em học tập thật tốt và luôn đạt điểm cao trong các bài thi bài kiểm tra trên lớp.
Biên soạn bởi: Trường THPT Ngô Thì Nhậm
Chuyên mục: Hoá học 10