Hóa học 10 Kết nối tri thức Bài 19: Tốc độ phản ứng – Giải bài tập SGK Hóa học 10 Kết nối tri thức Bài 19
Hóa học 10 Kết nối tri thức Bài 19: Tốc độ phản ứng được THPT Ngô Thì Nhậm biên soạn hy vọng sẽ là là tài liệu hữu ích giúp các em nắm vững kiến thức bài học và đạt kết quả tốt trong các bài thi, bài kiểm tra trên lớp.
Tóm tắt lý thuyết Hóa học 10 Kết nối tri thức Bài 19
I. Tốc độ phản ứng hóa học
1. Khái niệm tốc độ phản ứng hóa học
– Tốc độ phản ứng của một phản ứng hóa học là đại lượng đặc trưng cho sự thay đổi nồng độ của chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian: giây (s), phút (min), giờ (h), ngày (d), …
– Tốc độ phản ứng kí hiệu là v, đơn vị tốc độ phản ứng là (đơn vị nồng độ) (đơn vị thời gian)-1, ví dụ: mol L-1 s-1 hay M s-1.
– Các phản ứng khác nhau xảy ra với tốc độ khác nhau:
2. Tốc độ trung bình của phản ứng
– Đa số các phản ứng có tốc độ giảm dần theo thời gian, để đặc trưng cho sự nhanh chậm của phản ứng trong một khoảng thời gian, ta dùng tốc độ phản ứng trung bình.
Như vậy: Tốc độ trung bình của phản ứng à tốc độ tính trung bình trong một khoảng thời gian phản ứng.
– Cho phản ứng tổng quát: aA + bB → dD + eE
Tốc độ phản ứng được tính dựa theo thay đổi nồng độ của một chất bất kì trong phản ứng theo quy ước
Trong đó: ∆CA; ∆CB; ∆CD; ∆CE lần lượt là biến thiên lượng các chất A, B, D, E trong khoảng thời gian Dt.
II. Các yếu tố ảnh hưởng đến tốc độ phản ứng
1. Ảnh hưởng của nồng độ đến tốc độ phản ứng
– Thông thường, khi nồng độ tăng, tốc độ phản ứng sẽ tăng.
– Giải thích:
+ Trong quá trình phản ứng, các hạt (phân tử, nguyên tử hoặc ion) luôn chuyển động không ngừng và va chạm với nhau. Những va chạm có năng lượng đủ lớn phá vỡ liên kết cũ, hình thành liên kết mới dẫn tới phản ứng hóa học được gọi là va chạm hiệu quả.
+ Khi nồng độ các chất phản ứng tăng lên, số va chạm giữa các hạt tăng lên, làm số va chạm hiệu quả cũng tăng lên và dẫn tới tốc độ phản ứng tăng.
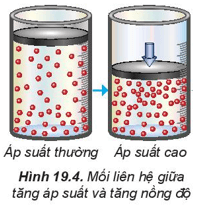
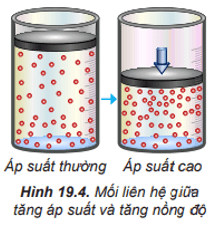
2. Ảnh hưởng của áp suất đến tốc độ phản ứng
– Trong hỗn hợp khí, nồng độ mỗi khí tỉ lệ thuận với áp suất của nó. Khi nén hỗn hợp khí (giảm thể tích) thì nồng độ mỗi khí tăng lên. Việc tăng áp suất hỗn hợp khí cũng tương tự như tăng nồng độ, sẽ làm tốc độ phản ứng tăng.
– Việc thay đổi áp suất không làm ảnh hưởng đến tốc độ của phản ứng không có chất khí tham gia.
3. Ảnh hưởng của nhiệt độ đến tốc độ phản ứng
– Khi tăng nhiệt độ, các hạt (phân tử, nguyên tử hoặc ion) sẽ chuyển động nhanh hơn, động năng cao hơn. Khi đó, số va chạm hiệu quả giữa các hạt tăng lên, dẫn đến tốc độ phản ứng tăng.
– Nhiệt độ càng cao, tốc độ phản ứng càng lớn. Với đa số các phản ứng, khi nhiệt độ tăng lên 10oC thì tốc độ phản ứng tăng từ 2 đến 4 lần. Giá trị g = 2 – 4 này gọi là hệ số nhiệt độ Van’t Hoff.
– Mối liên hệ của hệ số Van’t Hoff với tốc độ và nhiệt độ
Trong đó, v2 và v1 là tốc độ phản ứng ở nhiệt độ T2 và T1 tương ứng.
4. Ảnh hưởng của diện tích bề mặt đến tốc độ phản ứng
– Khi tăng diện tích bề mặt tiếp xúc, số va chạm giữa các chất đầu tăng lên, số va chạm hiệu quả cũng tăng theo, dẫn đến tốc độ phản ứng tăng.
– Chú ý:
+ Nếu kích thước hạt càng nhỏ thì tổng diện tích bề mặt càng lớn, nên có thể tăng diện tích tiếp xúc bằng cách đập nhỏ hạt.
+ Ngoài ra, có thể tăng diện tích bề mặt của một khối bằng cách tạo nhiều đường rãnh, lỗ xốp trong lòng khối chất đó. Khi đó, diện tích bề mặt bao gồm diện tích bề mặt trong và diện tích bề mặt ngoài.
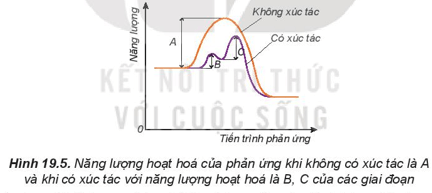
5. Ảnh hưởng của chất xúc tác đến tốc độ phản ứng
– Khi có xúc tác, phản ứng sẽ xảy ra qua nhiều giai đoạn. Mỗi giai đoạn đều có năng lượng hoạt hóa thấp hơn so với phản ứng không xúc tác. Do đó, số hạt có đủ, năng lượng hoạt hóa sẽ nhiều hơn, dẫn đến tốc độ phản ứng tăng lên.
– Chú ý:
+ Năng lượng hoạt hóa là năng lượng tối thiểu cần cung cấp cho các hạt (nguyên tử, phân tử hoặc ion) để va chạm giữa chúng gây ra phản ứng hóa học.
+ Sau phản ứng, khối lượng và bản chất của chất xúc tác không đổi, tuy nhiên, kích thước, hình dạng hạt, độ xốp, … có thể thay đổi.
III. Một số ứng dụng của việc thay đổi tốc độ phản ứng
– Trong đời sống và sản xuất, con người áp dụng nhiều biện pháp kĩ thuật để thay đổi tốc độ phản ứng như thay đổi nồng độ, nhiệt độ, dùng chất xúc tác, …
Giải bài tập SGK Hóa học 10 Kết nối tri thức Bài 19
Mở đầu trang 92 Hóa học 10
Làm thế nào có thể so sánh sự nhanh, chậm của các phản ứng hoá học để thúc đẩy hoặc kìm hãm nó theo mong muốn?
Lời giải:
Để so sánh sự nhanh, chậm của các phản ứng hóa học, chúng ta có thể dựa vào tốc độ phản ứng hóa học.
Câu hỏi 1 trang 93 Hóa học 10
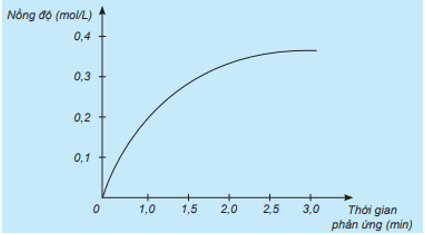
Xét phản ứng: H2 + Cl2 → 2HCl.
Nghiên cứu sự thay đổi nồng độ một chất trong phản ứng theo thời gian, thu được đồ thị sau:
a) Đồ thị này mô tả sự thay đổi nồng độ theo thời gian của chất nào?
b) Nêu đơn vị của tốc độ phản ứng trong trường hợp này.
Lời giải:
a) Đồ thị trên mô tả sự thay đổi nồng độ theo thời gian của HCl vì nồng độ của HCl tăng dần từ 0 mol/L theo thời gian.
b) Đơn vị của tốc độ phản ứng trong trường hợp này là mol/(L.min).
Hoạt động trang 95 Hóa học 10
Nghiên cứu ảnh hưởng của nồng độ đến tốc độ phản ứng:
Na2S2O3 + H2SO4 → Na2SO4 + S + SO2 + H2O
Chuẩn bị: Các dung dịch: Na2S2O3 0,05 M, Na2S2O3 0,10 M, Na2S2O3 0,30 M, H2SO4 0,5 M; 3 bình tam giác, đồng hồ bấm giờ, tờ giấy trắng có kẻ chữ X.
Tiến hành:
– Cho vào mỗi bình tam giác 30 mL dung dịch Na2S2O3 với các nồng độ tương ứng là 0,05 M; 0,10 M và 0,30 M. Đặt các bình lên tờ giấy trắng có kẻ sẵn chữ X.
– Rót nhanh vào mỗi bình 30 mL dung dịch H2SO4 0,5 M và bắt đầu bấm giờ.
Lưu ý: Phản ứng có sinh ra khí độc. Cần tiến hành cẩn thận và tránh ngửi trực tiếp trên miệng bình tam giác.
Quan sát vạch chữ X trên tờ giấy dưới đáy bình, ghi lại thời điểm không nhìn thấy vạch chữ X nữa và trả lời câu hỏi:
1. Phản ứng ở bình nào xảy ra nhanh nhất? Chậm nhất?
2. Nồng độ ảnh hưởng thế nào đến tốc độ phản ứng?
Lời giải:
1. Phản ứng ở bình chứa dung dịch Na2S2O3 có nồng độ 0,3M xảy ra nhanh nhất.
Phản ứng ở bình chứa dung dịch Na2S2O3 có nồng độ 0,05M xảy ra chậm nhất.
2. Khi nồng độ các chất tham gia tăng, tốc độ phản ứng sẽ tăng.
Câu hỏi 3 trang 96 Hóa học 10
Cho phản ứng: X + Y → XY
Biết tốc độ phản ứng tỉ lệ thuận với nồng độ của các chất tham gia phản ứng với số mũ là hệ số tỉ lượng của chất đó trong phương trình hoá học.
a) Hãy viết phương trình tốc độ của phản ứng này.
b) Ở một nhiệt độ xác định, hằng số tốc độ của phản ứng này là 2,5.10-4 L/(mol.s). Nồng độ đầu của X và Y lần lượt là 0,02 M và 0,03 M. Hãy tính tốc độ phản ứng:
– Tại thời điểm đầu.
– Tại thời điểm đã hết một nửa lượng X.
Lời giải:
a) Phương trình tốc độ của phản ứng: v = k.CX.CY
b) Tốc độ phản ứng tại thời điểm đầu là:
v = 2,5.10-4.0,02.0,03 = 1,5.10-7 (mol/(L.s))
– Tại thời điểm đã hết một nửa lượng X
⇒ Nồng độ X còn 0,01M và đã phản ứng 0,01M
⇒ Theo phương trình, nồng độ Y phản ứng là 0,01M
⇒ Tại thời điểm xét, nồng độ Y còn 0,03M – 0,01M = 0,02M
⇒ v = 2,5.10-4.0,01.0,02 = 5.10-8 (mol/(L.s))
Câu hỏi 4 trang 97 Hóa học 10
Nêu mối liên hệ giữa nồng độ và áp suất của khí trong hỗn hợp.
Lời giải:
Trong hỗn hợp khí, nồng độ mỗi khí tỉ lệ thuận với áp suất của nó. Khi nén hỗn hợp khí (giảm thể tích) thì nồng độ mỗi khí tăng lên và ngược lại.
Câu hỏi 5 trang 97 Hóa học 10
Áp suất ảnh hưởng đến tốc độ phản ứng nào sau đây?
N2(g) + 3H2(g) → 2NH3(g) (1)
CO2(g) + Ca(OH)2(aq) → CaCO3(s) + H2O (l) (2)
SiO2(s) + CaO(s) → CaSiO3(s) (3)
BaCl2(aq) + H2SO4(aq) → BaSO4(s) + 2HCl(aq) (4)
Lời giải:
(1) và (2): Tăng áp suất làm tăng tốc độ phản ứng.
(3) và (4): Thay đổi áp suất không làm ảnh hưởng đến tốc độ của phản ứng vì không có sự tham gia của chất khí.
Câu hỏi 6 trang 98 Hóa học 10
Hãy giải thích tại sao khi nhiệt độ tăng thì tốc độ phản ứng tăng.
Lời giải:
Khi tăng nhiệt độ, các hạt (phân tử, nguyên tử hoặc ion) sẽ chuyển động nhanh hơn, động năng cao hơn. Khi đó, số va chạm hiệu quả giữa các hạt tăng lên, dẫn đến tốc độ phản ứng tăng.
Câu hỏi 7 trang 98 Hóa học 10
Nêu ý nghĩa của hệ số nhiệt độ Van’t Hoff.
Lời giải:
Trong đó, γ là hệ số nhiệt độ Van’t Hoff, vT là tốc độ phản ứng tại nhiệt độ T, vT+10 là tốc độ phản ứng tại nhiệt độ T +10.
⇒ Ý nghĩa: Giá trị của γ càng lớn thì ảnh hưởng của nhiệt độ đến tốc độ phản ứng càng mạnh.
Câu hỏi 8 trang 98 Hóa học 10
Ở 20 °C, tốc độ một phản ứng là 0,05 mol/(L.min). Ở 30 °C, tốc độ phản ứng này là 0,15 mol/(L.min).
a) Hãy tính hệ số nhiệt độ Van’t Hoff của phản ứng trên.
b) Dự đoán tốc độ phản ứng trên ở 40 °C (giả thiết hệ số nhiệt độ γ trong khoảng nhiệt độ này không đổi).
Lời giải:
a) Hệ số nhiệt độ Van’t Hoff của phản ứng là 3
b) Ta có: 3 x 0,15 = 0,45 mol/(L.min)
Câu hỏi 9 trang 99 Hóa học 10
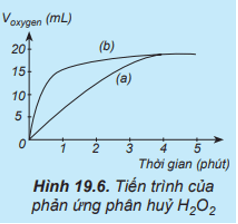
Thực hiện hai phản ứng phân huỷ H2O2 một phản ứng có xúc tác MnO2, một phản ứng không xúc tác. Đo thể tích khí oxygen theo thời gian và biểu diễn trên đồ thị như hình bên:
Đường phản ứng nào trên đồ thị (Hình 19.6) tương ứng với phản ứng có xúc tác, với phản ứng không có xúc tác?
Lời giải:
Đường phản ứng (a) trên đồ thị tương ứng với phản ứng không có xúc tác.
Đường phản ứng (b) trên đồ thị tương ứng với phản ứng có xúc tác vì lượng khí oxygen thoát ra ngay từ phút đầu tiên đã nhiều hơn.
Câu hỏi 10 trang 100 Hóa học 10
Yếu tố nào đã được áp dụng để làm thay đổi tốc độ của các phản ứng trong Hình 19.7?
Lời giải:
Yếu tố được áp dụng để làm thay đổi tốc độ của các phản ứng trong Hình 19.7 là:
a) Đèn xì oxygen – acetylene: nồng độ (tăng oxygen).
b) Tủ lạnh bảo quản thức ăn: nhiệt độ.
c) Bình dưa muối: chất xúc tác.
Câu hỏi 11 trang 100 Hóa học 10
Phản ứng tạo NO từ NH3 là một giai đoạn trung gian trong quá trình sản xuất nitric acid: 4NH3(g) +5O2(g) → 4NO(g) + 6H2O(g)
Hãy nêu một số cách để tăng tốc độ phản ứng này.
Lời giải:
Các cách để tăng tốc độ phản ứng:
– Tăng nồng độ của chất tham gia phản ứng.
– Sử dụng chất xúc tác: Platinum (Pt) ( hoặc Fe2O3, Cr2O3)
– Tăng nhiệt độ.
Em có thể trang 100 Hóa học 10
Giải thích được tại sao nhiều phản ứng hoá học trong công nghiệp cần tiến hành ở nhiệt độ cao và sử dụng chất xúc tác.
Lời giải:
Trong công nghiệp, tổng hợp với số lượng lớn các chất hóa học từ những nguồn nguyên liệu dồi dào. Tuy nhiên, có những chất tham gia cần năng lượng lớn để phá vỡ liên kết mới tham gia phản ứng được hoặc có những phản ứng phản ứng xảy ra chậm.
⇒ Có nhiều phản ứng trong công nghiệp cần tiến hành ở nhiệt độ cao và sử dụng chất xúc tác.
Trắc nghiệm Hóa học 10 Kết nối tri thức Bài 19 có đáp án
Bài 1: Hòa tan hoàn toàn x mol CuFeS2 bằng dung dịch HNO3 đặc, nóng (dư) sinh ra y mol NO2 (sản phẩm khử duy nhất của N+5). Biểu thức liên hệ giữa x và y là
A. y = 17x
B. x = 15y
C. x = 17y
D. y = 15x
Lời giải
Đáp án: A
(CuFeS2)0 (x) → Cu+2 + Fe+3 + 2S+6 + 17e (17x mol)
N+5 + 1e (y) → N+4 (y mol)
Bảo toàn e ⇒ 17x = y
Bài 2: Cho từng chất: C, Fe, BaCl2, Fe3O4, Fe2O3, FeCO3, Al2O3, H2S, HI, HCl, AgNO3, Na2SO3 lần lượt phản ứng với H2SO4 đặc, nóng. Số phản ứng thuộc loại phản ứng oxi hóa – khử là
A. 5
B. 6
C. 7
D. 9
Lời giải
Đáp án: B
Bài 3: Cho dãy các chất: HCl, SO2, F2, Fe2+, Al, Cl2. Số phân tử và ion trong dãy vừa có tính oxi hóa, vừa có tính khử là
A. 3
B. 4
C. 5
D. 6
Lời giải
Đáp án: B
Bài 4: Cho m gam hỗn hợp X gồm Cu, Fe vào dung dịch HCl dư, thu được 8,96 lít khí H2 (đktc). Cũng cho m gam hỗn hợp X trên vào dung dịch H2SO4 đặc, nóng dư, thoát ra 20,16 lít khí SO2 (đktc). Giá trị của m là
A. 41,6
B. 54,4
C. 48,0
D. 46,4
Lời giải
Đáp án: A
Fe + 2HCl → FeCl2 + H2
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H2O
Cu + 2H2SO4 → CuSO4 + SO2 + H2O
m = 0,4. 56 + 0,3. 64 = 41,6(g)
Bài 5: Hòa tan 0,9 gam một kim loại M (hóa trị không đổi) vào dung dịch HNO3 dư, thu được 0,28 lít (đktc) khí N2O duy nhất. Kim loại M là
A. Mg
B. Zn
C. Al
D. Ag
Lời giải
Đáp án: C
gọi hóa trị của kim loại là n
M → M+n + ne
2N+5 + 8e (0,1) → 2N+1 (0,0125 mol) (N2O)
Bảo toàn e ⇒ nM = 0,1/n
mM = 0,1/n. M = 0,9 ⇒ M = 9n
M = 27 (n = 3) ⇒ M là Al
Bài 6: Cho m gam Al tan hết trong dung dịch HNO3 dư, thu được 8,96 lít (đktc) hỗn hợp khí X gồm NO và N2O. Tỉ khối của X so với H2 là 16,75. Giá trị của m là
A. 15,3
B. 8,1
C. 9,0
D. 10,8
Lời giải
Đáp án: A
nX = 0,4 mol;
Sử dụng sơ đồ đường chéo ⇒ nNO = 0,3 mol; nN2O = 0,1 mol
Nhường e: Al → Al+3 + 3e
Nhận e: N+5 + 3e → N+2
2N+5 + 8e → 2N+1 (N2O)
Bảo toàn e: ne nhường = ne nhận = 3nNO + 8nN2O = 1,7 mol
⇒ 3nAl = 1,7 ⇒ nAl = 17/30 ⇒ m = 15,3g
Bài 7: Khi cho 9,6 gam Mg tác dụng hết với dung dịch H2SO4 thì có 49 gam H2SO4 tham gia phản ứng, tạo ra một sản phẩm khử X. Chất X là
A. SO2
B. S
C. H2
D. H2S
Lời giải
Đáp án: D
nMg = 0,4 mol; nH2SO4 = 0,5 mol
nSO42- (trong muối) = nMgSO4 = nMg = 0,4
⇒ S+6 bị khử = 0,5 – 0,4 = 0,1 mol
ne nhường = ne nhận = 2 nMg = 0,8 mol = 8 nS+6 bị khử
⇒ S+6 + 8e → S-2 ⇒ Sản phẩm khử là H2S
Bài 8: Hòa tan m gam Fe trong HNO3 dư thấy sinh ra hỗn hợp khí chứa 0,03 mol NO2 và 0,02 mol NO. Giá trị của m là
A. 0,56
B. 1,12
C. 2,24
D. 1,68
Lời giải
Đáp án: D
Sử dụng định luật bảo toàn e:
⇒ nFe = 1/3(nNO2 + 3nNO) = 0,03 mol ⇒ m = 0,03. 56 = 1,68g
Bài 9: Cho 1,15 gam X gồm Cu, Mg, Al tác dụng hết với dung dịch HNO3, thu được 0,01 mol NO và 0,04 mol NO2 (không có sản phẩm khử nào khác). Khối lượng muối thu được là
A. 5,69 gam
B. 4,45 gam
C. 4,25 gam
D. 5,49 gam
Lời giải
Đáp án: D
Muối thu được Cu(NO3)2; Mg(NO3)2; Al(NO3)3
nNO3– (trong muối) = 2nCu + 2nMg + 3nAl = ne cho
ne nhận = ne cho = 3nNO + nNO2 = 0,07 mol
mmuối = mKL + NO3– = 1,15 + 0,07. 62 = 5,49g
Bài 10: Cho m gam hỗn hợp X gồm Mg, Al, Zn vào dung dich HCl dư, thu được 4,48 lít khí H2 (đktc). Cũng cho m gam hỗn hợp X trên phản ứng hoàn toàn với V lít khí O2 (đktc) tạo thành hỗn hợp các oxit. Giá trị của V là
A. 2,24
B. 4,48
C. 3,36
D. 2,80
Lời giải
Đáp án:
Khi pư với HCl ⇒ ne cho = 2nH2 = 0,4 mol
⇒ Khi phản ứng với oxi: nO2 = 1/4ne cho = 0,1
⇒ V = 2,24l
Bài 11: Cho phản ứng sau: Na2SO3 + KMnO4 + X → Na2SO4 + MnO2 + KOH.
Chất X là
A. H2SO4
B. HCl
C. NaOH
D. H2O
Lời giải
Đáp án: D
Bài 12: Cho phản ứng sau:
NaNO2 + K2Cr2O7 + X → NaNO3 + Cr2(SO4)3 + K2SO4 + H2O.
Chất X là
A. Na2SO4
B. H2SO4
C. K2SO4
D. KOH
Lời giải
Đáp án: B
Bài 13: Cho phản ứng: M2Ox + HNO3 → M(NO3)3 + ___
Khi x nhận giá trị nào sau đây thì phản ứng trên không thuộc loại phản ứng oxi hóa – khử?
A. 1
B. 2
C. 3
D. 4
Lời giải
Đáp án: C
Bài 14: Trong phản ứng oxi hóa – khử, chất bị oxi hóa là
A. chất nhận electron.
B. chất nhường electron.
C. chất làm giảm số oxi hóa.
D. chất không thay đổi số oxi hóa.
Lời giải
Đáp án: B
Bài 15: Phản ứng nào sau đây là phản ứng tự oxi hóa, tự khử?
A. NH4NO3 → N2O + 2H2O
B. 4Al(NO3)3 → 2Al2O3 + 12NO2 + 3O2 ↑
C. Cl2 + 2NaOH → NaCl + NaClO + H2O
D. 2KMnO4 → K2MnO4 + MnO2 + O2 ↑
Lời giải
Đáp án: C
Bài 16: Cho phương trình hóa học: Al + HNO3 → Al(NO3)3 + NO + N2O + H2O.
(Biết tỉ lệ thể tích N2O : NO =1 : 3)
Sau cân bằng phương trình hóa học trên với hệ số các chất là những số nguyên, tối giản thì hệ số của HNO3 là
A. 66
B. 60
C. 51
D. 63
Lời giải
Đáp án: A
******************
Trên đây là nội dung bài học Hóa học 10 Kết nối tri thức Bài 19: Tốc độ phản ứng do THPT Ngô Thì Nhậm biên soạn bao gồm phần lý thuyết, giải bài tập và các câu hỏi trắc nghiệm có đáp án đầy đủ. Hy vọng các em sẽ nắm vững kiến thức về Tốc độ phản ứng. Chúc các em học tập thật tốt và luôn đạt điểm cao trong các bài thi bài kiểm tra trên lớp.
Biên soạn bởi: Trường THPT Ngô Thì Nhậm
Chuyên mục: Hoá học 10