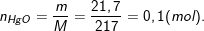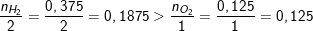Hoá 8 bài 31: Tính chất hoá học của Hidro (H2), ứng dụng của Hidro và bài tập vận dụng. Hidro H2 là chất khí không màu, không mùi, không vị, tan rất ít trong nước và nhẹ nhất trong tất cả các khí. Hidro được ứng dụng để làm nhiên liệu cho động cơ tên lửa hay làm nguồn nguyên liệu để sản xuất ra Amoniac, Axit,…
Vậy Hidro (H2) có tính chất hoá học và tính chất vật lý gì? Hidro được ứng dụng vào những lĩnh vực cụ thể nào trong đời sống thực tế, chúng ta cùng tìm hiểu qua bài viết dưới đây.
• Sơ lược về Hidro H2
– Ký hiệu nguyên tố hidro: H
– Nguyên tử khối của hidro: 1
– Phân tử khối (đơn chất) của hidro: 2
I. Tính chất vật lý của Hidro (H2)
– Hidro là chất khí không màu, không mùi, không vị, rất ít tan trong nước và là chất khí nhẹ nhất trong không khí.
– 1 lít nước (ở 15°C) hòa tan được 20 ml khí H2.
– Tỉ khối của H2 đối với không khí: dH2/kk = 2/29.
II. Tính chất hoá học của Hidro (H2)
- Hidro tác dụng với Oxi
- Hidro tác dụng với đồng oxit
1. Hidro tác dụng với Oxi (H2 + O2)
– Hidro phản ứng oxi ở nhiệt độ thích hợp theo PTPƯ:
2H2 + O2 ![xrightarrow[]{t^{0}}](https://hayhochoi.vn/uploads/news/wyswyg/2019_05/1557998834nlkfblsbjf.gif)
– Hỗn hợp H2 và O2 là hổn hợp nổ. Hỗn hợp nổ mạnh nhất khi tỉ lệ H2:O2 là 2:1 về thể tích.
2. Hidro tác dụng với đồng oxit (H2 + CuO)
– Hidro phản ứng với đồng oxit ở nhiệt độ khoảng 400°C theo PTPƯ:
H2 + CuO ![xrightarrow[]{400^{0}C}](https://hayhochoi.vn/uploads/news/wyswyg/2019_05/1557998836wor8r6cn96.gif)
– Trong phản ứng trên, hidro đã chiếm chỗ của oxi trong CuO. Ta nói hidro có tính khử.
III. Ứng dụng của Hidro
* Hidro có nhiều ứng dụng trong đời sống và sản xuất như:
– Làm nhiên liệu cho động cơ tên lửa, nhiên liệu động cơ thay thế cho xăng.
– Hàn cắt kim loại với đèn xì oxi-hidro.
– Là nguyên liệu để sản xuất amonicac NH3, axit clohidric HCl và nhiều hợp chất hữu cơ.
– Dùng làm chất khử để điều chế kim loại từ những oxit của chúng.
– Dùng bơm cho khinh khí cầu.
IV. Bài tập về Hidro.
Bài 1 trang 109 SGK hoá 8: Viết phương trình hóa học của phản ứng hiđro khử các oxit sau:
a) Sắt (III) oxit.
b) Thủy ngân(II) oxit.
c) Chì(II) oxit.
* Lời giải bài 1 trang 109 SGK hoá 8:
a) Fe2O3 + 3H2 → 2Fe + 3H2O.
b) HgO + H2 → Hg + H2O.
c) PbO + H2 → Pb + H2O.
Bài 2 trang 109 SGK hoá 8: Hãy kể những ứng dụng của hidro mà em biết.
* Lời giải bài 2 trang 109 SGK hoá 8:
Dùng làm nhiên liệu cho động cơ tên lửa, có thể làm nhiên liệu cho động cơ ô tô thay cho xăng, dùng trong đèn xì oxi – hidro để hàn cắt kim loại. Đó là vì khí hiđro cháy, sinh ra một lượng nhiệt lớn hơn nhiều lần so với cùng lượng nhiên liệu khác.
Là nguồn nhiên liệu trong sản xuất amoniac, axit và nhiều hợp chất hữu cơ.
Dùng làm chất khử để điều chế một số kim loại từ oxit của chúng.
Hiđro được dùng để bơm vào khinh khí cầu, bóng thám không vì là khí nhẹ nhất.
Bài 3 trang 109 SGK hoá 8: Chọn cụm từ thích hợp trong khung để điền vào chỗ trống trong các câu sau:
Tính khử; tính oxi hóa; chiếm oxi; nhường oxi; nhẹ nhất
Trong các chất khí, hiđro là khí … Khí hidro có …
Trong phản ứng giữa H2 và CuO, H2 có … vì … của chất khác; CuO có … vì … cho chất khác.
* Lời giải bài 3 trang 109 SGK hoá 8:
Trong các chất khí, hiđro là khí nhẹ nhất. Khí hiđro có tính khử.
Trong phản ứng giữa H2 và CuO, H2 có tính khử vì chiếm oxi của chất khác, CuO có tính oxi hoá vì nhường oxi cho chất khác.
Bài 4 trang 109 SGK hoá 8: Khử 48 gam đồng(II) oxit bằng khí hiđro. Hãy:
a) Tính số gam đồng kim loại thu được.
b) Tính thể tích khí hiđro (đktc) cần dùng.
* Lời giải bài 4 trang 109 SGK hoá 8:
– Theo bài ra, ta có: nCuO = 48/80 = 0,6 mol.
– Phương trình hóa học phản ứng khử CuO:
CuO + H2 → Cu + H2O.
– Theo PTPƯ: nCu = nCuO = 0,6 (mol).
⇒ mCu = 0,6 .64 = 38,4g.
– Theo phương trình phản ứng trên:
nH2 = nCuO = 0,6 (mol).
⇒ VH2 = 0,6.22,4 = 13,44 lít.
Bài 5 trang 109 SGK hoá 8: Khử 21,7 gam thủy ngân(II) oxit bằng hiđro. Hãy:
a) Tính số gam thủy ngân thu được.
b) Tính số mol và thể tích khí hiđro (đktc) cần dùng.
* Lời giải bài 5 trang 109 SGK hoá 8:
– Theo bài ra, ta có:
– Phương trình hóa học phản ứng khử HgO:
HgO + H2 → Hg + H2O
– Theo PTPƯ nHg = nHgO = 0,1 (mol).
⇒ mHg = 0,1 .201 = 20,1g.
– heo PTPƯ: nH2 = nHgO = 0,1 (mol).
⇒ VH2 = 0,1.22,4 =2,24(l).
Bài 6 trang 109 SGK hoá 8: Tính số gam nước thu được khi cho 8,4 lít khí hiđro tác dụng với 2,8 lít oxi (các thể tích đo ở đktc).
* Lời giải bài 6 trang 109 SGK hoá 8:
– Theo bài ra, ta có:
– Phương trình hóa học phản ứng tạo nước:
2H2 + O2 → 2H2O.
* Ta cần lập tỉ lệ mol để xem oxi phản ứng hế hay hidro phản ứng hết:
– Theo PTPƯ: 2 mol Hidro phản ứng với 1 mol Oxi
– Theo bài ra: 0,375 là số mol hidro và 0,125 là của Oxi
– Như vậy ta có tỉ lệ mol Hidro và Oxi như sau:
⇒ Như vậy lượng H2 dư nên tính khối lượng nước sinh ra theo oxi.
– Theo phương trình phản ứng trên ta có:
nH2O = 2.nO2 = 2.0,125 = 0,25 (mol).
⇒ mH2O = 0,25 .18 = 4,5(g).
Hy vọng với bài viết về tính chất hoá học của Hidro (H2), ứng dụng của Hidro và bài tập ở trên giúp ích cho các em. Mọi góp ý và thắc mắc các em vui lòng để lại bình luận dưới bài viết để THPT Ngô Thì Nhậm ghi nhận và hỗ trợ, chúc các em học tập tốt.
Đăng bởi: THPT Ngô Thì Nhậm
Chuyên mục: Giáo Dục